Contracción del músculo esquelético
Aproximadamente el 40% del cuerpo es músculo esquelético, y tal vez otro 10% es músculo liso y cardíaco

Anatomía fisiológica del músculo esquelético :
Fibras del músculo esquelético
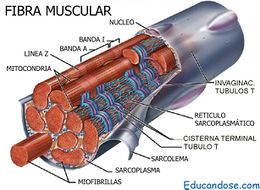
Todos los músculos esqueléticos están formados por numerosas fibras cuyo diámetro varía entre 10 y 80 μm. Cada una de estas fibras está formada por subunidades cada vez más pequeñas
Todas las fibras, excepto alrededor de un 2%, habitualmente están inervadas por una sola terminación nerviosa localizada cerca del punto medio de la fibra
El sarcolema:
es una fina membrana que envuelve a una fibra musculoesquelética denominada membrana plasmática, y una cubierta externa formada por una capa delgada de material polisacárido que contiene numerosas fibrillas delgadas de colágeno.
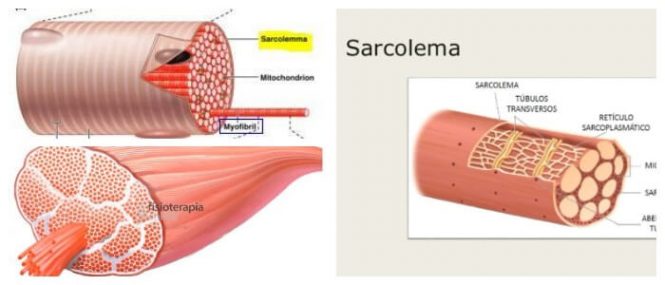
Las miofibrillas
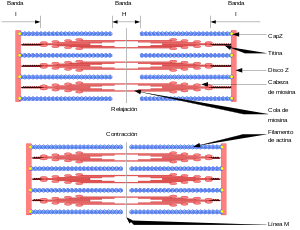
Cada fibra muscular contiene varios cientos a varios miles de miofibrillas, que se representan en la vista en sección transversal. Cada miofibrilla está formada por aproximadamente 1.500 filamentos de miosina y 3.000 filamentos de actina adyacentes entre sí, que son grandes moléculas proteicas polimerizadas responsables de la contracción muscular real
Las bandas claras contienen solo filamentos de actina y se denominan bandas I porque son isótropas a la luz polarizada. Las bandas oscuras contienen filamentos de miosina, así como los extremos de los filamentos de actina en el punto en el que se superponen con la miosina, y se denominan bandas A porque son anisótropas a la luz polarizada.
El disco Z, que está formado por proteínas filamentosas distintas de los filamentos de actina y miosina, atraviesa las miofibrillas y también pasa desde unas miofibrillas a otras, uniéndolas entre sí a lo largo de toda la longitud de la fibra muscular.
Las moléculas filamentosas de titina mantienen en su lugar los filamentos de miosina y actina:
- La relación de yuxtaposición entre los filamentos de miosina y de actina se mantiene por medio de un gran número de moléculas filamentosas de una proteína denominada titina
- Estas moléculas elásticas de titina actúan como armazón que mantiene en su posición los filamentos de miosina y de actina, de modo que funcione la maquinaria contráctil del sarcómero.
- . La molécula de titina también parece actuar como molde para la formación inicial de porciones de los filamentos contráctiles del sarcómero, especialmente los filamentos de miosina.
El sarcoplasma
Las muchas miofibrillas de cada fibra muscular están yuxtapuestas suspendidas en la fibra muscular. Los espacios entre las miofibrillas están llenos de un líquido intracelular denominado sarcoplasma, que contiene grandes cantidades de potasio, magnesio y fosfato, además de múltiples enzimas proteicas.

El retículo sarcoplásmico:
En el sarcoplasma que rodea a las miofibrillas de todas las fibras musculares también hay un extenso retículo tiene una organización especial que es muy importante para regular el almacenamiento, la liberación y la recaptación de calcio y, por tanto, para controlar la contracción muscular.

Mecanismo general de la contracción muscular
El inicio y la ejecución de la contracción muscular se producen en las siguientes etapas secuenciales:
- 1. Un potencial de acción viaja a lo largo de una fibra motora hasta sus terminales sobre las fibras musculares.
- 2. En cada terminal, el nervio secreta una pequeña cantidad de la sustancia neurotransmisora acetilcolina.
- 3. La acetilcolina actúa en una zona local de la membrana de la fibra muscular para abrir múltiples canales de cationes «activados por acetilcolina» a través de moléculas proteicas que flotan en la membrana.
- 4. La apertura de los canales activados por acetilcolina permite que grandes cantidades de iones sodio difundan hacia el interior de la membrana de la fibra muscular. Esta acción provoca una despolarización local que, a su vez, conduce a la apertura de los canales de sodio activados por el voltaje, que inicia un potencial de acción en la membrana.
- 5. El potencial de acción viaja a lo largo de la membrana de la fibra muscular de la misma manera que los potenciales de acción viajan a lo largo de las membranas de las fibras nerviosas.
- 6. El potencial de acción despolariza la membrana muscular, y buena parte de la electricidad del potencial de acción fluye a través del centro de la fibra muscular, donde hace que el retículo sarcoplásmico libere grandes cantidades de iones calcio que se han almacenado en el interior de este retículo.
- 7. Los iones calcio inician fuerzas de atracción entre los filamentos de actina y miosina, haciendo que se deslicen unos sobre otros en sentido longitudinal, lo que constituye el proceso contráctil.
- 8. Después de una fracción de segundo los iones calcio son bombeados de nuevo hacia el retículo sarcoplásmico por una bomba de Ca++ de la membrana y permanecen almacenados en el retículo hasta que llega un nuevo potencial de acción muscular; esta retirada de los iones calcio desde las miofibrillas hace que cese la contracción muscular.

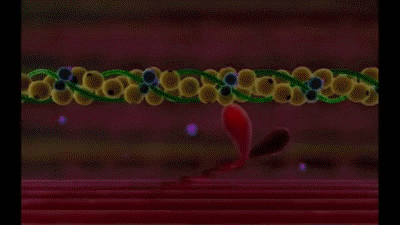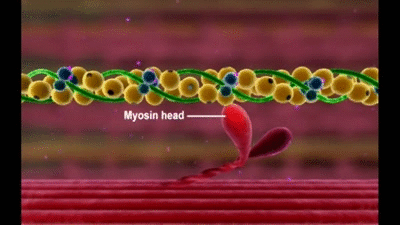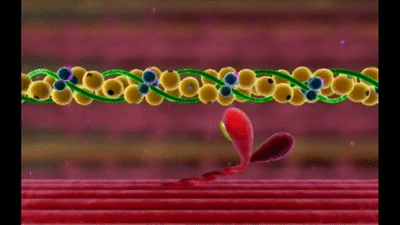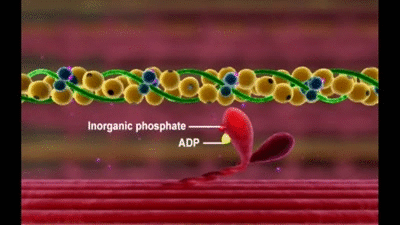

Mecanismo molecular de la contracción muscular
La contracción muscular se produce por un mecanismo de deslizamiento de los filamentos.
En el estado relajado, los extremos de los filamentos de actina que se extienden entre dos discos Z sucesivos apenas comienzan a superponerse entre sí.

En el estado contraído estos filamentos de actina han sido traccionados hacia dentro entre los filamentos de miosina, de modo que sus extremos se superponen entre sí en su máxima extensión
Esta acción está producida por las fuerzas que se generan por la interacción de los puentes cruzados que van desde los filamentos de miosina a los filamentos de actina
Características moleculares de los filamentos contráctiles

Los filamentos de miosina están compuestos por múltiples moléculas de miosina.
La molécula de miosina está formada por seis cadenas polipeptídicas, dos cadenas pesadas, cada una de las cuales tiene un peso molecular de aproximadamente 200.000, y cuatro cadenas ligeras, que tienen un peso molecular de aproximadamente 20.000 cada una. Las dos cadenas pesadas se enrollan entre sí en espiral para formar una hélice doble, que se denomina cola de la molécula de miosina. Un extremo de cada una de estas cadenas se pliega bilateralmente para formar una estructura polipeptídica globular denominada cabeza de la miosina. Así, hay dos cabezas libres en un extremo de la molécula de miosina de doble hélice. Las cuatro cadenas ligeras también forman parte de la cabeza de la miosina, dos en cada cabeza. Estas cadenas ligeras ayudan a controlar la función de la cabeza durante la contracción muscular.
Cada puente cruzado es flexible en dos puntos denominados bisagras, una en el punto en el que el brazo sale del cuerpo del filamento de miosina y la otra en el punto en el que la cabeza se une al brazo.
Actividad adenosina trifosfatasa de la cabeza de miosina :
Otra característica de la cabeza de la miosina que es esencial para la contracción muscular es que actúa como una enzima adenosina trifosfatasa (ATPasa)
Esta propiedad permite que la cabeza escinda el ATP y que utilice la energía procedente del enlace fosfato de alta energía del ATP para aportar energía al proceso de la contracción.
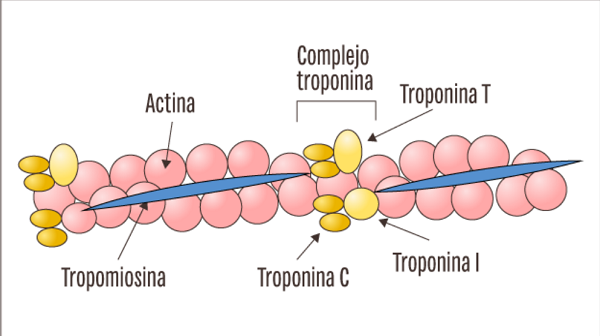
Los filamentos de actina están formados por actina, tropomiosina y troponina:
El esqueleto del filamento de actina es una molécula de la proteína F-actina bicatenaria, Las dos hebras están enroscadas en una hélice de la misma manera que la molécula de miosina.
tropomiosina
El filamento de actina también contiene otra proteína, la tropomiosina. Cada molécula de tropomiosina tiene un peso molecular de 70.000 y una longitud de 40 nm. Estas moléculas están enrolladas en espiral alrededor de los lados de la hélice de F-actina. En estado de reposo las moléculas de tropomiosina recubren los puntos activos de las hebras de actina, de modo que no se puede producir atracción entre los filamentos de actina y de miosina para producir la contracción.
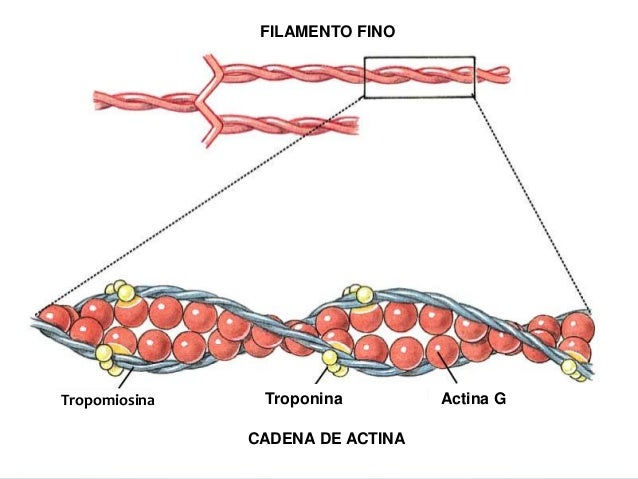
Troponina
Estas moléculas proteicas son en realidad complejos de tres subunidades proteicas unidas entre sí de manera laxa, cada una de las cuales tiene una función específica en el control de la contracción muscular. Una de las subunidades (troponina I) tiene una gran afinidad por la actina, otra (troponina T) por la tropomiosina y la tercera (troponina C) por los iones calcio.