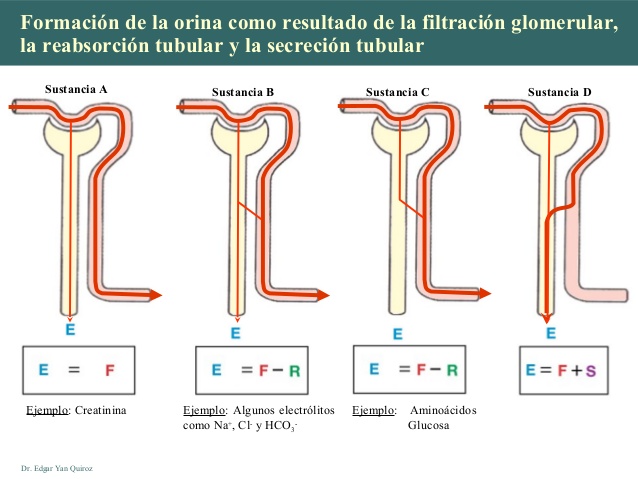
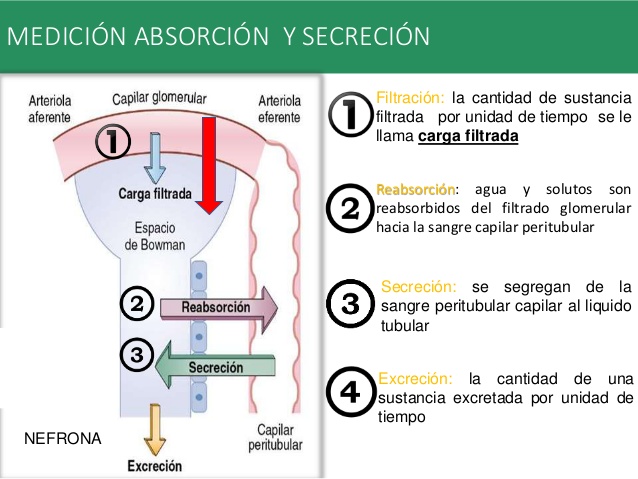
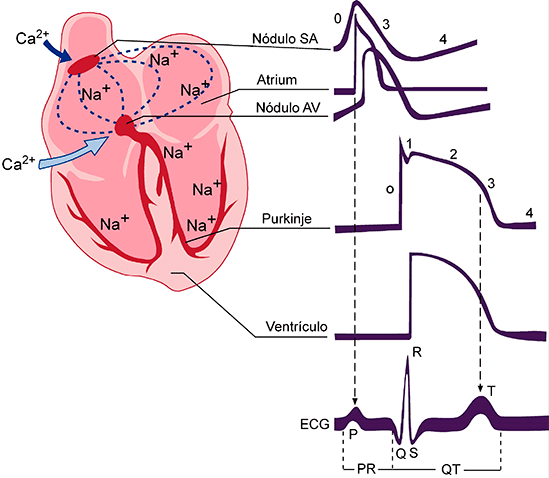
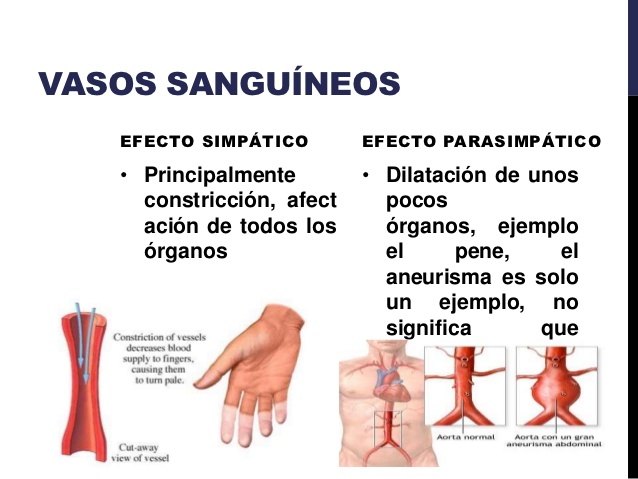
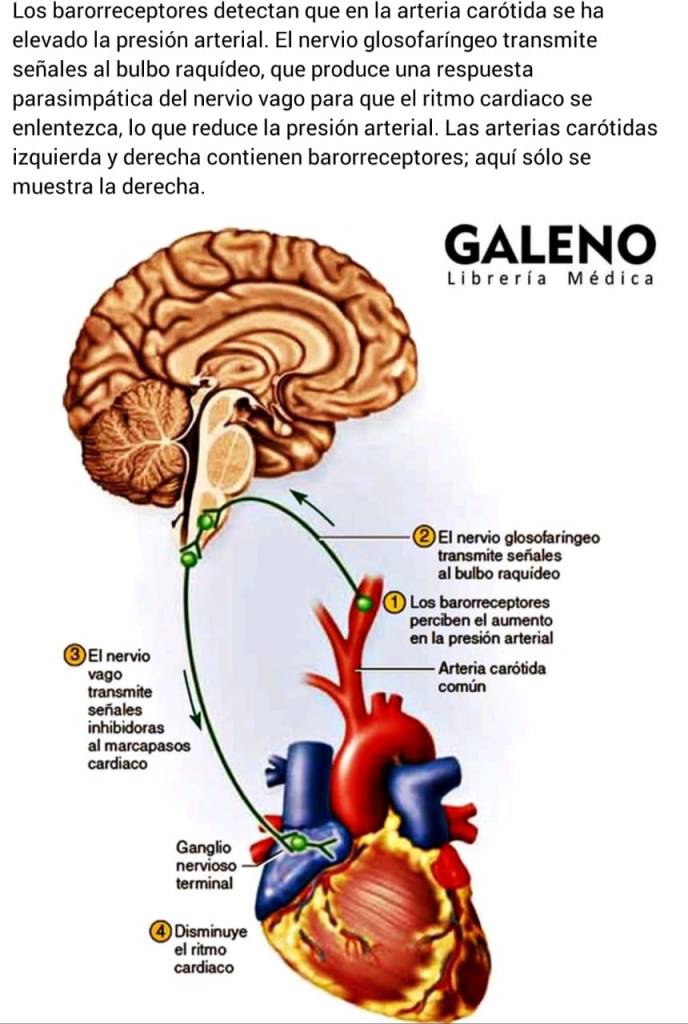
Hormonas hipofisarias y su control por el
hipotálamo
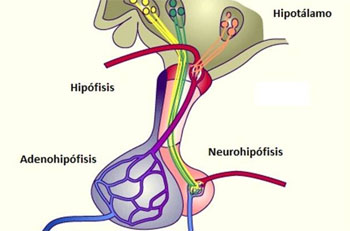
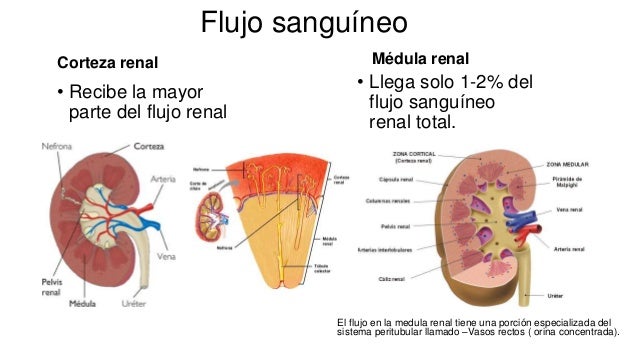
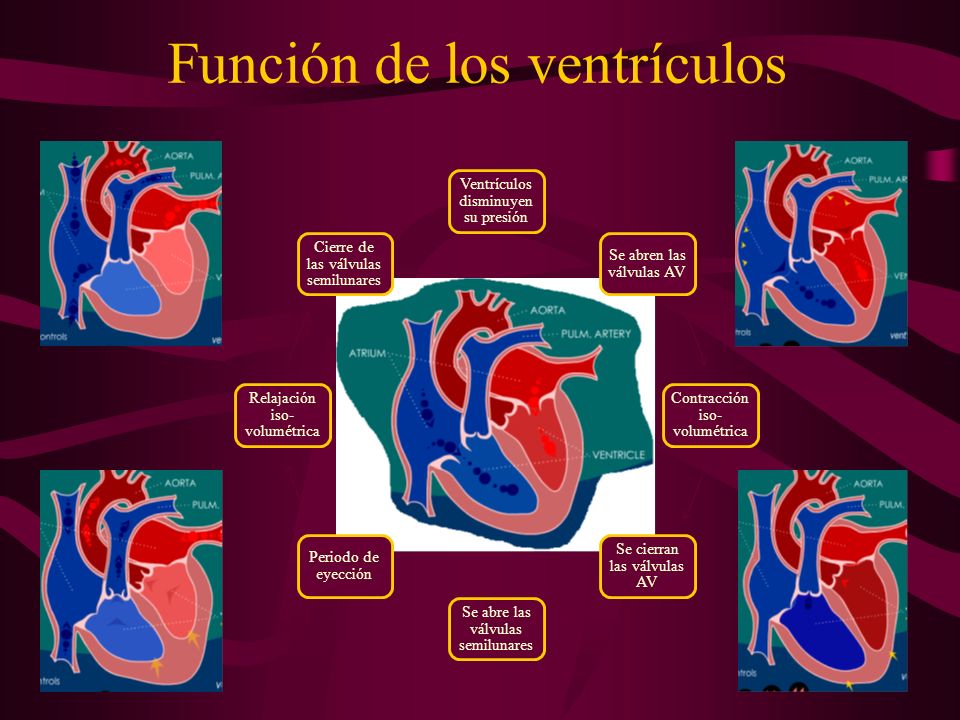
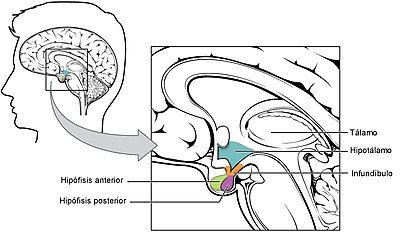
La hipófisis y su relación con el hipotálamo
Adenohipófisis y neurohipófisis
glándula pituitaria, es una pequeña glándula de
alrededor de 1 cm de diámetro y 0,5-1 g de peso, situada en la silla turca (una cavidad ósea de la base
del cráneo) y unida al hipotálamo mediante el tallo hipofisario. Desde una perspectiva fisiológica, la
hipófisis se divide en dos partes bien diferenciadas: el lóbulo anterior o adenohipófisis y el lóbulo
posterior o neurohipófisis.
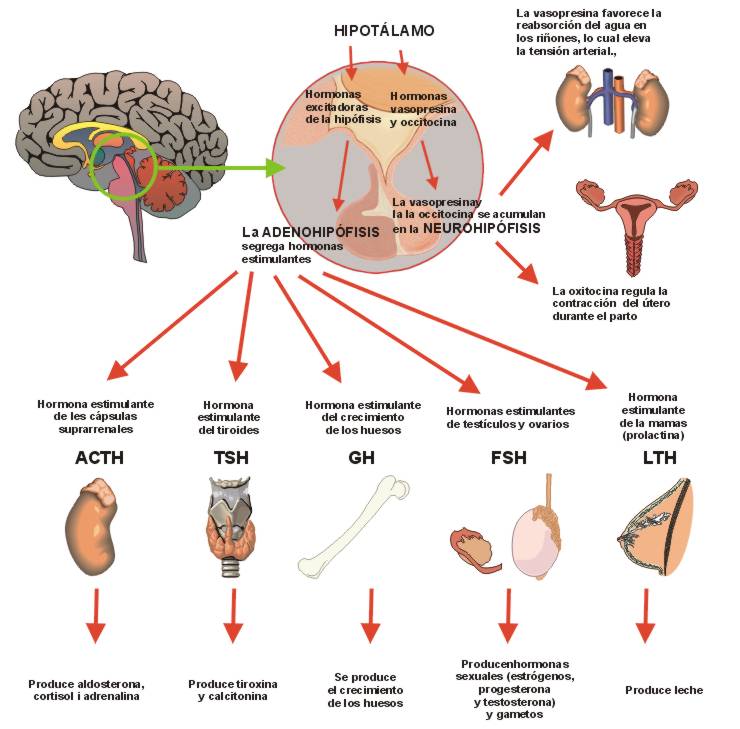
La adenohipófisis secreta seis hormonas peptídicas necesarias y otras de menor importancia, mientras que la neurohipófisis sintetiza dos hormonas peptídicas importantes.
Las hormonas de la adenohipófisis intervienen en el control de las funciones metabólicas de todo el organismo

La hormona del crecimiento estimula el crecimiento de todo el cuerpo mediante su acción sobre la
formación de proteínas y sobre la multiplicación y diferenciación celulares.
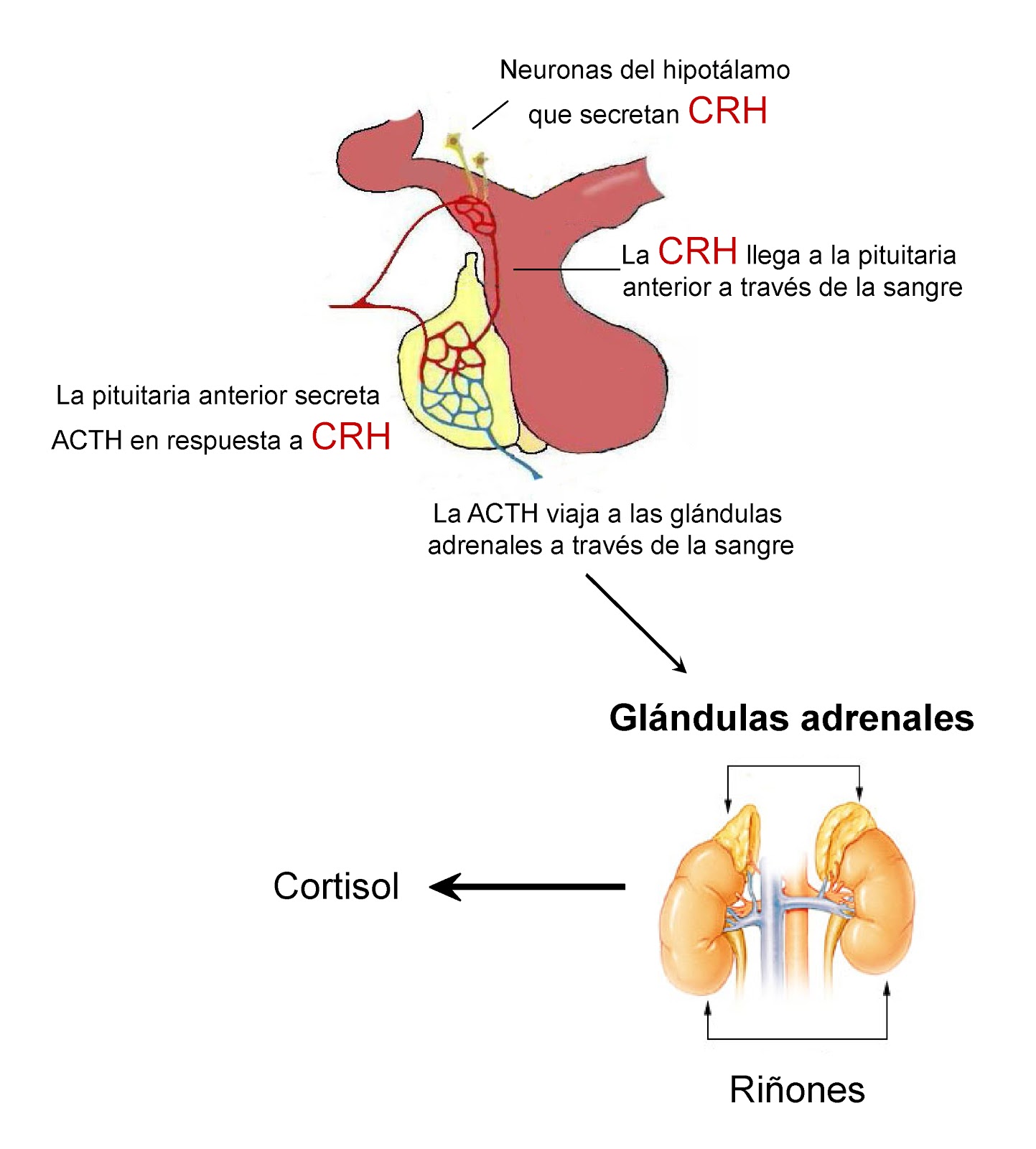
La corticotropina controla la secreción de algunas hormonas corticosuprarrenales, que, a su vez,
afectan al metabolismo de la glucosa, las proteínas y los lípidos.
La tirotropina (hormona estimulante del tiroides) controla la secreción de tiroxina y triyodotironina
por la glándula tiroides; a su vez, estas hormonas regulan casi todas las reacciones químicas
intracelulares que tienen lugar en el organismo.

La prolactina estimula el desarrollo de las glándulas mamarias y la producción de leche

hormona estimulante de los folículos y la hormona
luteinizante, controlan el crecimiento de los ovarios y los testículos, así como su actividad
hormonal y reproductora. Las dos hormonas secretadas por la neurohipófisis desempeñan otras
funciones.
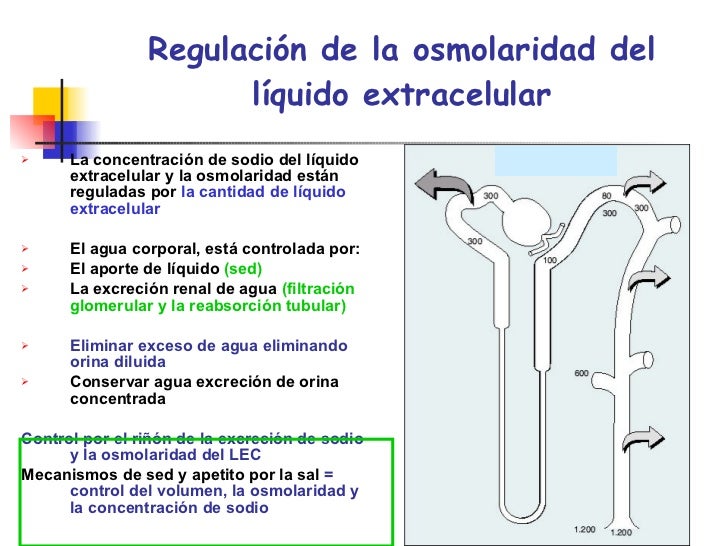
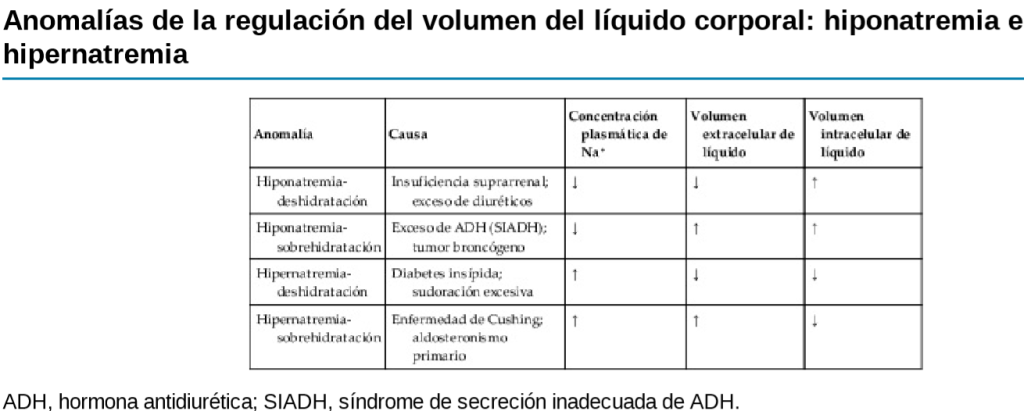
La hormona antidiurética (denominada también vasopresina) controla la excreción de agua en la
orina, con lo que ayuda a regular la concentración hídrica en los líquidos corporales.
La oxitocina contribuye a la secreción de leche desde las glándulas mamarias hasta los pezones
durante la lactancia; posiblemente, interviene también en el parto, al final de la gestación.
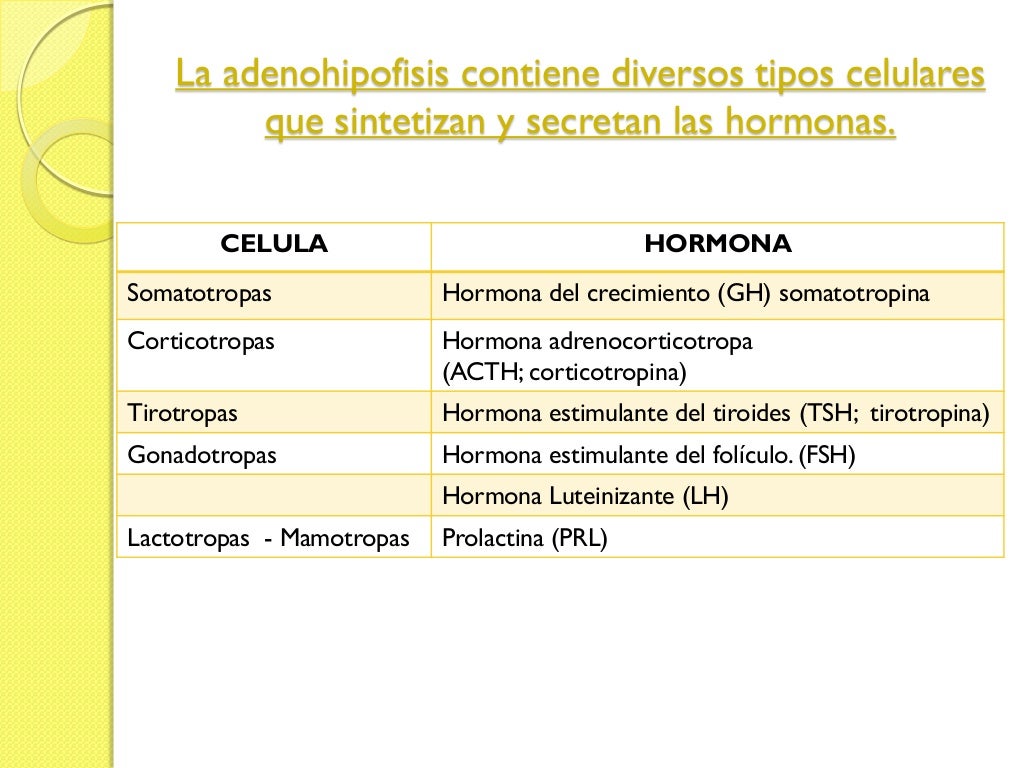
Los cinco tipos de células son:
- Somatótropas: hormona del crecimiento humana (GH).
- Corticótropas: corticotropina (ACTH).
- Tirótropas: tirotropina (TSH).
- Gonadótropas: hormonas gonadótropas, es decir, la hormona luteinizante (LH) y la hormona
foliculoestimulante (FSH). - Lactótropas: prolactina (PRL).
Las hormonas neurohipofisarias se sintetizan en cuerpos celulares situados en el hipotálamo
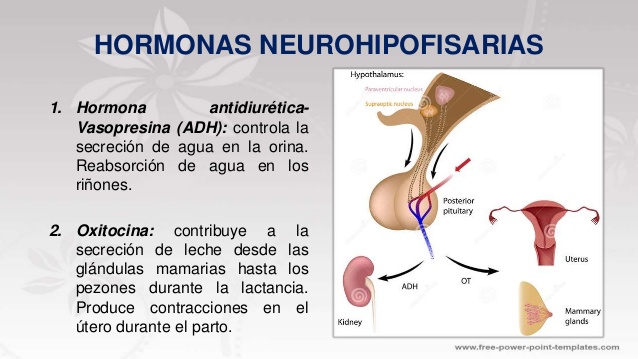
Los cuerpos de las células que secretan las hormonas neurohipofisarias no se encuentran en la propia} neurohipófisis, sino que corresponden a grandes neuronas denominadas neuronas magnocelulares, ubicadas en los núcleos supraóptico y paraventricular del hipotálamo; el axoplasma de las fibras nerviosas neuronales transporta las hormonas desde el hipotálamo a la neurohipófisis.

El hipotálamo controla la secreción hipofisaria
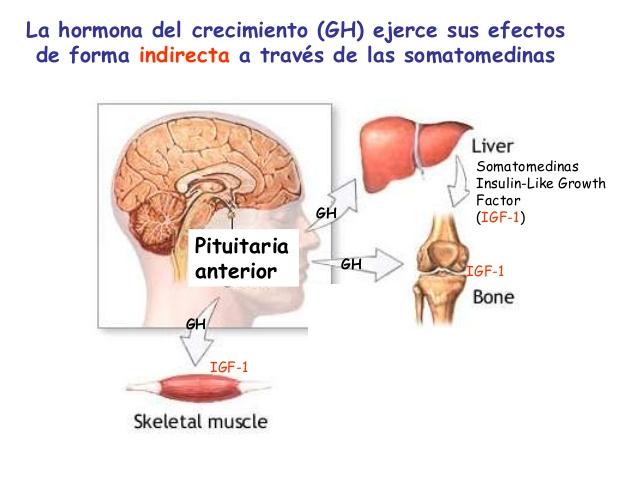
Funciones fisiológicas de la hormona del crecimiento
Todas las hormonas adenohipofisarias más importantes, salvo la hormona del crecimiento, ejercen sus efectos principalmente mediante la estimulación de las glándulas efectoras, como la glándula tiroides, la corteza suprarrenal, los ovarios, los testículos y las glándulas mamarias.
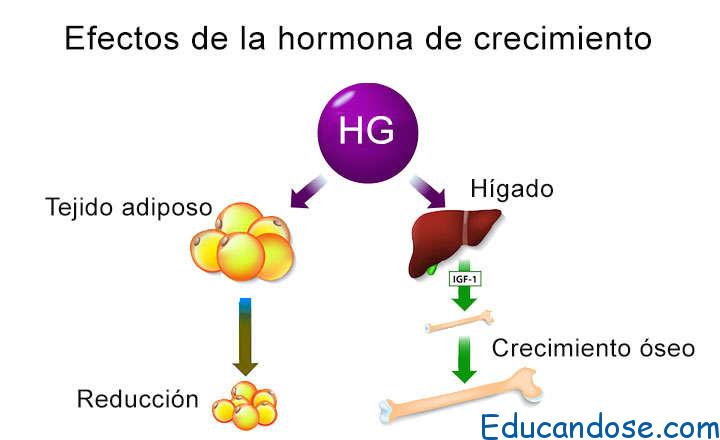
La hormona del crecimiento estimula el crecimiento de
muchos tejidos corporales
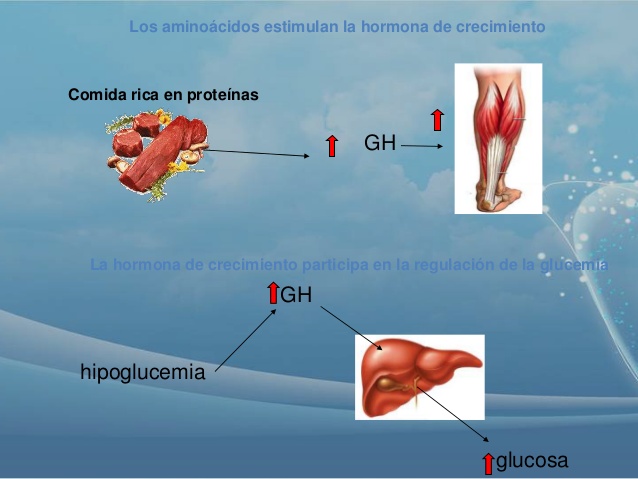
La hormona del crecimiento, denominada también hormona somatótropa o somatotropina, es una molécula proteica pequeña que contiene 191 aminoácidos en una sola cadena, con un peso molecular de 22.005. Induce el crecimiento de casi todos los tejidos del organismo que conservan esa capacidad.
Favorece el aumento de tamaño de las células y estimula la mitosis, dando lugar a un número creciente de células y a la diferenciación de determinados tipos celulares, como las células del crecimiento óseo y los miocitos precoces.
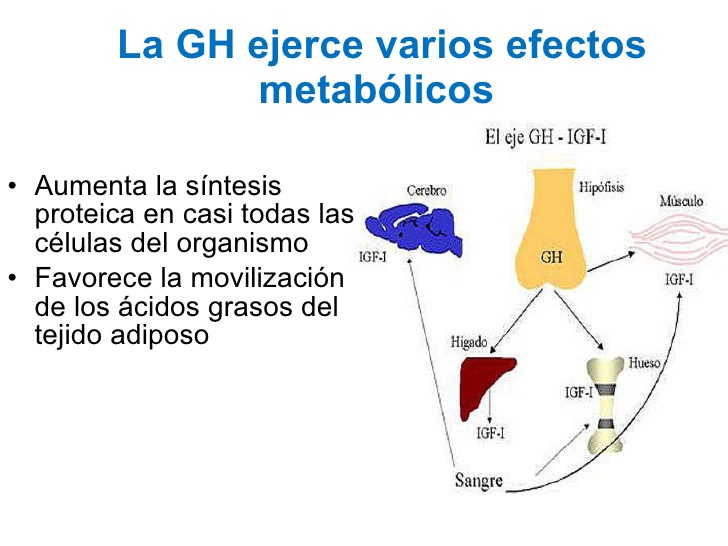
La hormona del crecimiento ejerce varios efectos metabólicos
Además de afectar al crecimiento general, la hormona del crecimiento ejerce múltiples efectos metabólicos específicos:
- Aumenta la síntesis proteica en casi todas las células del organismo
- Favorece la movilización de los ácidos grasos del tejido adiposo, incrementa la cantidad de ácidos grasos libres en la sangre y potencia el uso de los ácidos grasos como fuente de energía
- Disminuye la cantidad de glucosa utilizada en todo el organismo
Aunque se ignoran los mecanismos exactos mediante los cuales la hormona del crecimiento potencia el depósito de proteínas, se conocen distintos efectos que podrían favorecerlo.
Facilitación del transporte de aminoácidos a través de las membranas celulares
La hormona del crecimiento intensifica el transporte de la mayoría de los aminoácidos a través de las membranas celulares, hacia el interior de la célula. Se eleva así la concentración celular de
aminoácidos, lo que parece explicar, al menos en parte, el incremento de la síntesis de proteínas.
Aumento de la traducción de ARN para facilitar la síntesis proteica en los ribosomas
Aunque la concentración de aminoácidos en las células no aumente, la hormona del crecimiento incrementa la traducción del ARN, haciendo que los ribosomas del citoplasma sinteticen un mayor número de proteínas.
Aumento de la transcripción nuclear del ADN para formar ARN
En períodos prolongados (de 24 a 48 h), la hormona del crecimiento estimula también la transcripción de ADN en el núcleo, haciendo que aumente la cantidad de ARN formado.
Descenso del catabolismo de las proteínas y los aminoácidos
Junto con el incremento de la síntesis de proteínas, se produce una disminución de la degradación de
las proteínas celulares
La hormona del crecimiento induce la liberación de los ácidos grasos del tejido adiposo y, por
consiguiente, aumenta su concentración en los líquidos corporales. Asimismo, intensifica la
conversión de ácidos grasos en acetil coenzima A (acetil-CoA) y su utilización subsiguiente como
fuente de energía en todos los tejidos del organismo. En consecuencia, bajo los efectos de la
hormona del crecimiento, los lípidos se usan como fuente de energía, en detrimento de los hidratos
de carbono y las proteínas.
La hormona del crecimiento ejerce múltiples efectos que repercuten en el metabolismo de los hidratos de carbono:
- Disminuye la captación de glucosa en los tejidos como el músculo esquelético
- y el tejido adiposo
- Aumenta la producción hepática de glucosa
- Incrementa la secreción de insulina.
Cada uno de estos cambios obedece a la «resistencia a la insulina» inducida por la hormona del crecimiento, que atenúa la acción de la hormona encargada de estimular la captación y la utilización de glucosa por el músculo esquelético y el tejido adiposo y de inhibir la producción hepática de glucosa; todo ello conlleva un incremento de la glucemia y un incremento compensador de la secreción insulínica.
Por estas razones, los efectos de la hormona del crecimiento se denominan diabetógenos y su secreción excesiva puede provocar alteraciones metabólicas muy similares a las observadas en los pacientes con diabetes de tipo II (diabetes no insulinodependiente), que también son muy resistentes a los efectos metabólicos de la insulina.
Necesidad de insulina y de hidratos de carbono para la estimulación del crecimiento por la hormona del crecimiento
La hormona del crecimiento no ejerce su acción en los animales que carecen de páncreas; tampoco lo hace cuando se eliminan de la alimentación los hidratos de carbono.
Estos fenómenos demuestran que la eficacia de la hormona requiere una actividad adecuada de la insulina y unos depósitos suficientes de hidratos de carbono.
La hormona del crecimiento estimula el crecimiento del cartílago y el hueso
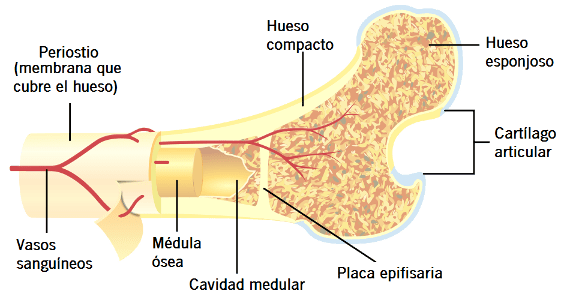
Existen dos mecanismos fundamentales que explican el crecimiento óseo: por lo que se refiere al primero, en respuesta a la estimulación de la hormona del crecimiento, la longitud de los huesos largos aumenta en los cartílagos epifisarios, donde las epífisis de los extremos del hueso están separadas de las diáfisis. Este crecimiento produce en primer lugar el depósito de cartílago nuevo, seguido de su conversión en hueso nuevo; en consecuencia, las diáfisis se alargan, separándose cada vez más de las epífisis.
Al mismo tiempo, el cartílago epifisario va desapareciendo, de modo que al final de la adolescencia ya no queda cartílago epifisario adicional que permita seguir creciendo a los huesos largos. En esas circunstancias tiene lugar la fusión ósea entre la diáfisis y la epífisis en cada uno de los extremos y el crecimiento en longitud de los huesos largos se detiene.
En el segundo mecanismo del crecimiento óseo, los osteoblastos del periostio óseo y de algunas cavidades óseas depositan hueso nuevo en la superficie del viejo.

La hormona del crecimiento ejerce muchos de sus efectos a través de sustancias intermedias denominadas somatomedinas
Cuando se aplica directamente hormona de crecimiento a los condrocitos cultivados fuera de organismo, rara vez proliferan o aumentan de tamaño. No obstante, cuando se inyecta al animal intacto, sí induce la proliferación y el crecimiento de esas mismas células.
Se ha propuesto que la mayoría o casi todos los efectos de la hormona del crecimiento se deberían a la somatomedina C y a otras somatomedinas y no a la acción directa de la hormona sobre los huesos y otros tejidos periféricos.
También cabe la posibilidad de que sea la propia hormona del crecimiento la responsable directa del aumento del crecimiento de algunos tejidos y de que el mecanismo de la somatomedina constituya un medio alternativo, pero no imprescindible, de favorecer el crecimiento.
Regulación de la secreción de hormona del crecimiento
Después de la adolescencia, la secreción disminuye lentamente con la edad y, en última instancia, alcanza el 25% del nivel de la adolescencia a una edad muy avanzada.
La secreción de hormona del crecimiento sigue un patrón pulsátil, con ascensos y descensos.
No se conocen los mecanismos exactos que controlan su secreción, pero existen diversos factores relacionados con la nutrición o el estrés que la estimulan:
- La inanición, en especial cuando existe un déficit grave de proteínas
- La hipoglucemia o baja concentración sanguínea de ácidos grasos
- El ejercicio
- La excitación
- Los traumatismos
- La grelina, una hormona secretada por el estómago antes de las comidas.

La concentración normal de hormona del crecimiento en el plasma adulto oscila entre 1,6 y
3 ng/ml, mientras que en los niños o adolescentes se aproxima a 6 ng/ml. Estos valores pueden aumentar hasta 50 ng/ml cuando se agotan las reservas de proteínas o de hidratos de carbono durante
la inanición prolongada.
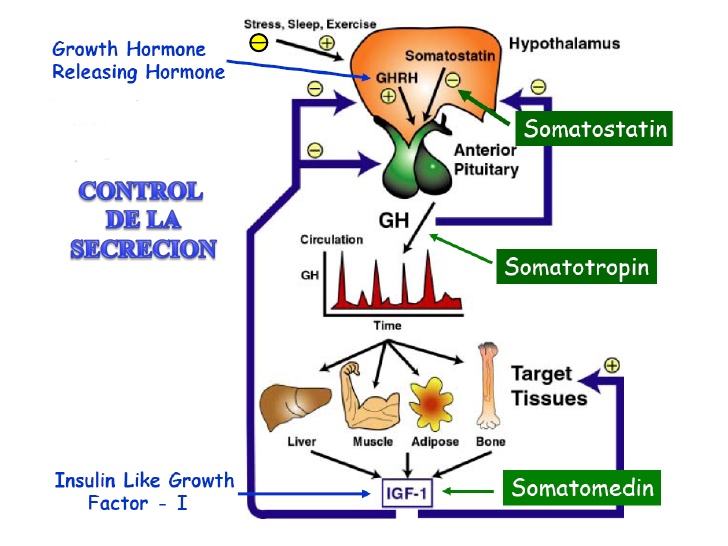
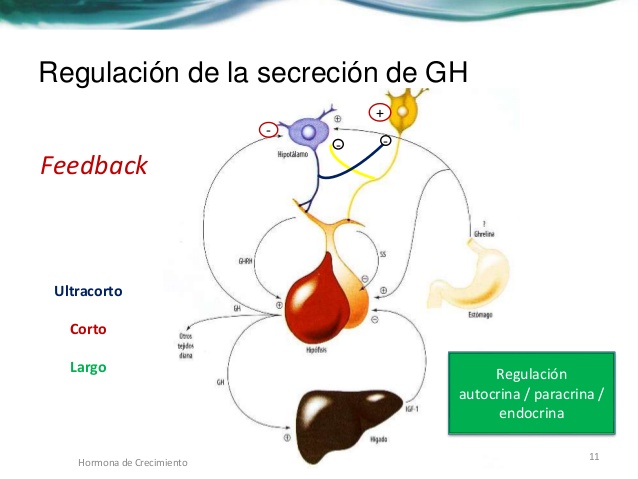
Función del hipotálamo, de la hormona liberadora de la hormona del crecimiento y de la somatostatina en el control de la secreción de hormona del crecimiento
Teniendo en cuenta la descripción anterior de los múltiples factores que afectan a la secreción de
hormona del crecimiento, resulta sencillo comprender la perplejidad de los fisiólogos a la hora de
desentrañar los misterios de la regulación de la secreción de hormona del crecimiento. Se sabe que está controlada por dos factores secretados en el hipotálamo y luego transportados a la adenohipófisis por los vasos porta hipotalámico-hipofisarios. Se trata de la hormona liberadora de la
hormona del crecimiento (GHRH) y de la hormona inhibidora de la hormona del crecimiento
(denominada también somatostatina).
La hormona liberadora de la hormona del crecimiento y de la somatostatina en el control de la secreción de hormona del crecimiento
El núcleo hipotalámico que induce la secreción de GHRH es el núcleo ventromedial, es decir, la misma región del hipotálamo sensible a la concentración sanguínea de glucosa que provoca la sensación de saciedad en la hiperglucemia y de hambre en la hipoglucemia.
La secreción de somatostatina está controlada por otras regiones adyacentes del hipotálamo. Por consiguiente, parece razonable pensar que las mismas señales que modifican el instinto por el que una persona se alimenta también afectan a la tasa de secreción de la hormona del crecimiento.
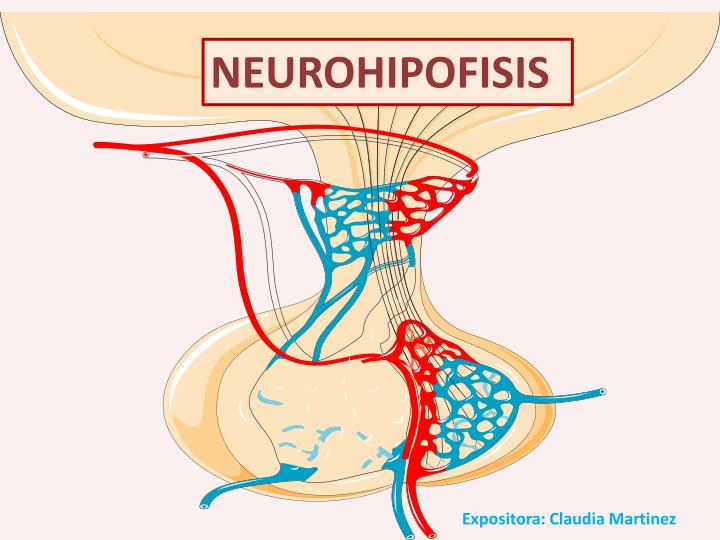
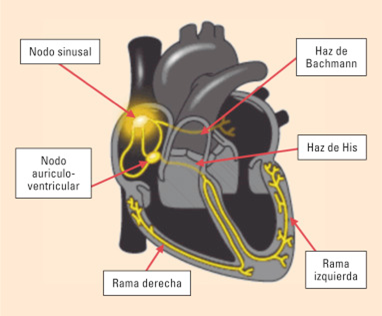
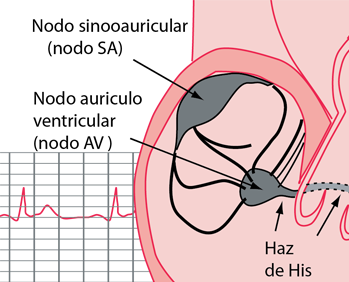
La neurohipófisis y su relación con el hipotálamo
La neurohipófisis, conocida también como hipófisis posterior o lóbulo posterior de la hipófisis, se compone sobre todo de células similares a las gliales, denominadas pituicitos. Estas células no secretan hormonas, sino que constituyen meras estructuras de sostén para un gran número de fibras nerviosas terminales y de terminaciones nerviosas de las vías procedentes de los núcleos supraóptico y paraventricular del hipotálamo.
Estas terminaciones reposan sobre la superficie de los capilares, hacia los que secretan dos hormonas neurohipofisarias: 1) hormona antidiurética (ADH),
llamada también vasopresina, y 2) oxitocina.
Si se secciona el tallo hipofisario por encima de la hipófisis pero se mantiene intacto todo el
hipotálamo, la secreción de hormonas neurohipofisarias disminuirá de forma transitoria y unos días después recuperará la normalidad; las hormonas se secretan entonces por las terminaciones seccionadas de las fibras del hipotálamo y no por las que se encuentran en la neurohipófisis.
Ambiente
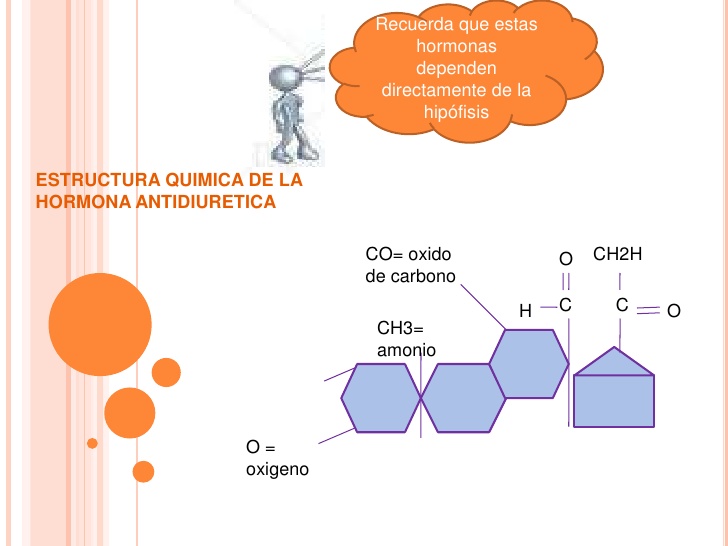
Estructuras químicas de la hormona antidiurética y la oxitocina
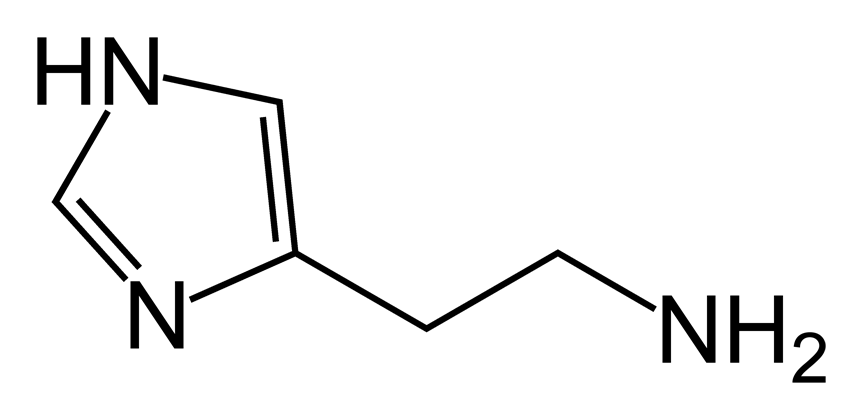
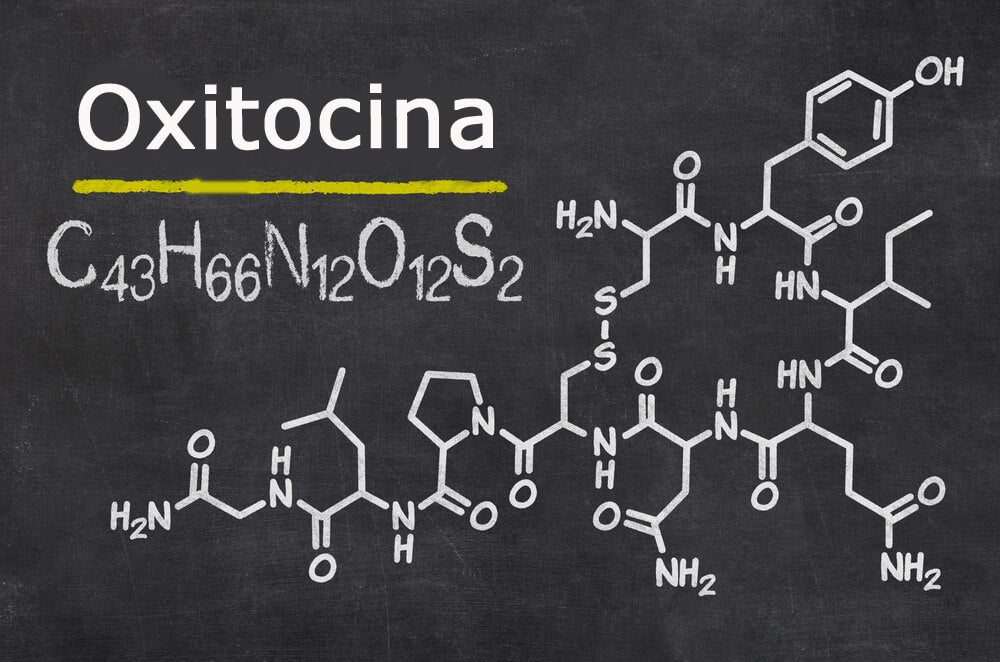
La oxitocina y la ADH (vasopresina) son polipéptidos de nueve aminoácidos cada uno, con las secuencias siguientes:
Vasopresina: Cis-Tir-Fen-Gln-Asn-Cis-Pro-Arg-GliNH2.
Oxitocina: Cis-Tir-Ile-Gln-Asn-Cis-Pro-Leu-GliNH2.
Obsérvese que estas dos hormonas son prácticamente idénticas, salvo porque la vasopresina contiene fenilalanina y arginina, en lugar de isoleucina y leucina. La similitud de ambas moléculas explica la semejanza de sus funciones.

Funciones fisiológicas de la hormona antidiurética
La inyección de cantidades minúsculas de ADH (de tan solo 2 ng) reduce la excreción renal de agua (antidiuresis)
La presencia de ADH, aumenta en gran medida la permeabilidad de los conductos y túbulos colectores, por lo que casi toda el agua se reabsorbe a medida que el líquido tubular atraviesa estos conductos, haciendo que el organismo conserve el agua y produzca una orina muy concentrada.
Sin la hormona, las membranas luminales de las células epiteliales de los túbulos son prácticamente impermeables al agua.
Cuando la ADH actúa en la célula, se combina primero con los receptores de membrana que activan a la adenilato ciclasa e inducen la formación de AMPc en el citoplasma de las células tubulares.
Esta formación, a su vez, provoca la fosforilación de los elementos contenidos en las vesículas especiales, lo que determina la inserción de dichas vesículas en las membranas celulares apicales y proporciona así numerosas zonas muy permeables al agua.

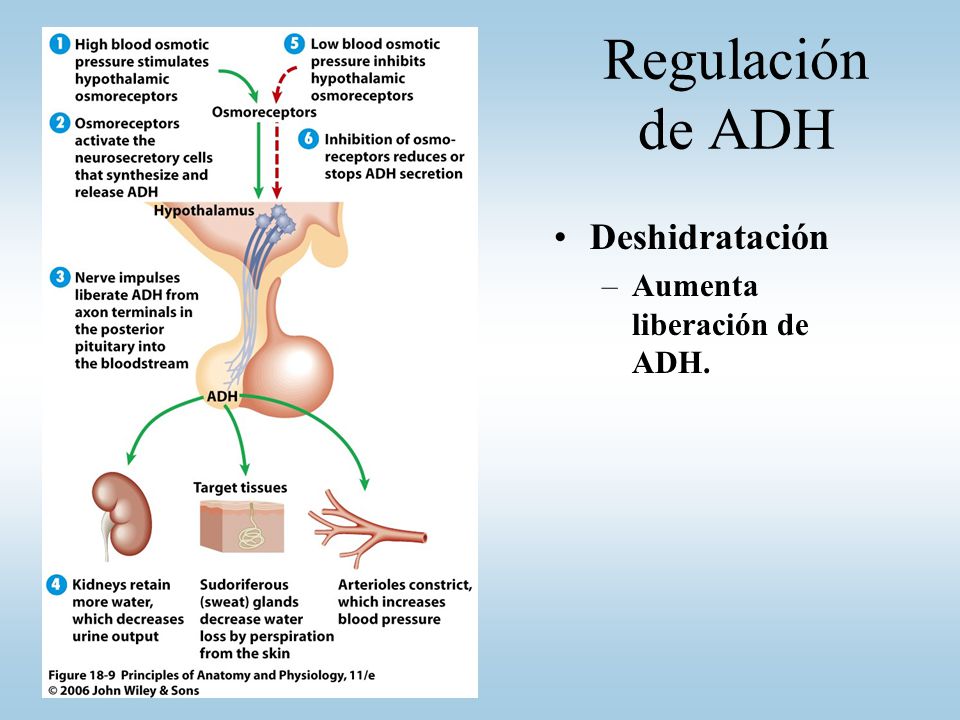
Regulación de la producción de hormona antidiurética
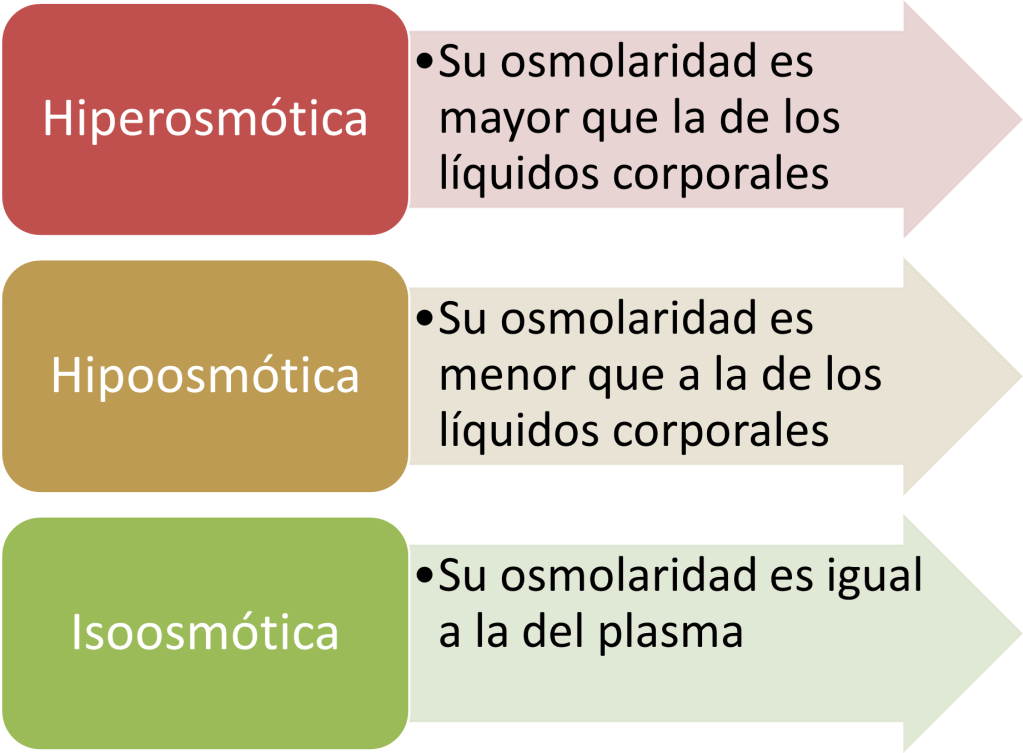
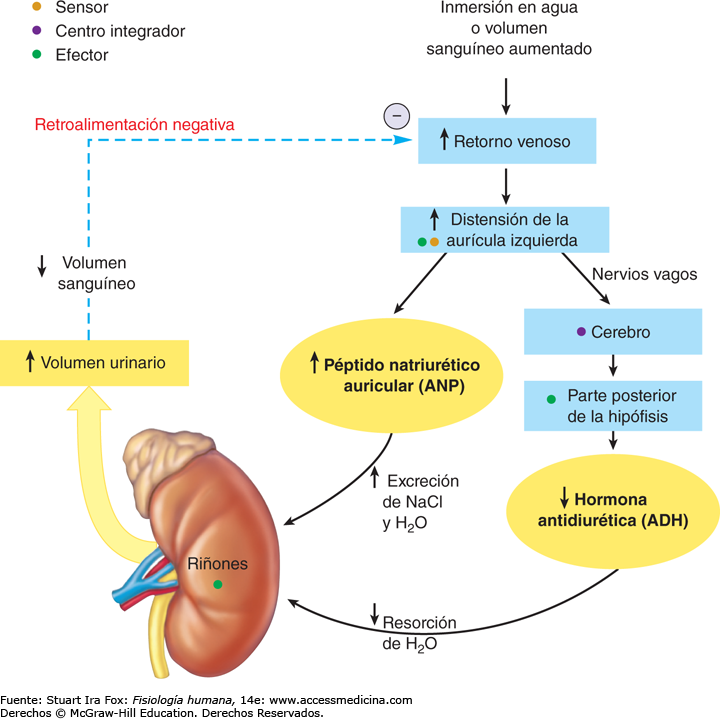
El aumento de la osmolalidad del líquido extracelular estimula la secreción de ADH
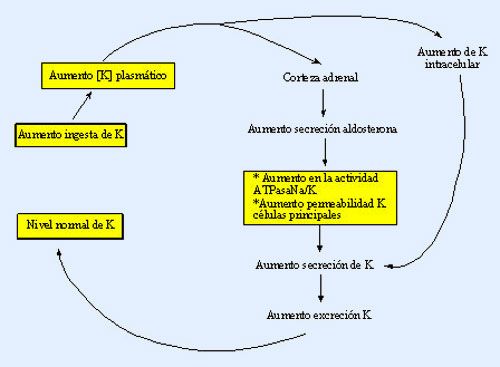
Cuando se inyecta una solución concentrada de electrólitos en la arteria que riega el hipotálamo, las
neuronas ADH de los núcleos supraóptico y paraventricular transmiten de inmediato impulsos a la neurohipófisis para que libere gran cantidad de ADH a la sangre circulante; de esta forma, la
secreción de la hormona aumenta, a veces incluso hasta 20 veces por encima de los valores normales.
Por el contrario, la inyección de una solución diluida en esta arteria interrumpe los impulsos y, por
consiguiente, la secreción de ADH.
Un volumen sanguíneo y una presión arterial bajos estimulan la secreción de ADH: efectos vasoconstrictores de la ADH
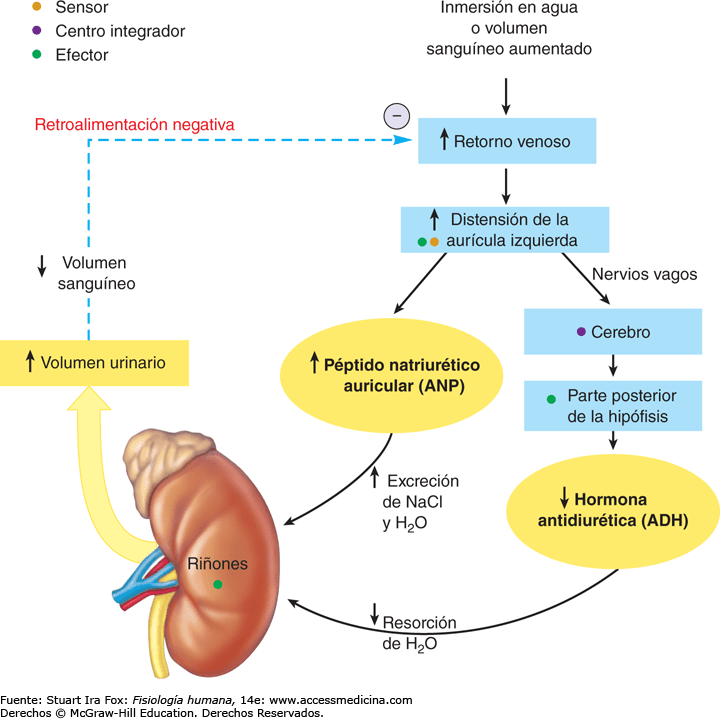
Cuando las concentraciones sanguíneas de ADH caen, la conservación renal de agua aumenta, mientras que cuando son elevadas, ejercen un potente efecto y contraen todas las arteriolas del
organismo, con el consiguiente ascenso de la presión arterial. Por esta razón, la ADH recibe también
el nombre de vasopresina.
Uno de los estímulos que intensifican la secreción de ADH consiste en la disminución del volumen sanguíneo; este efecto resulta especialmente llamativo cuando el volumen sanguíneo desciende en un 15 a un 25% o más; en estas condiciones, la secreción de la hormona llega a aumentar hasta 50 veces por encima de su valor normal.
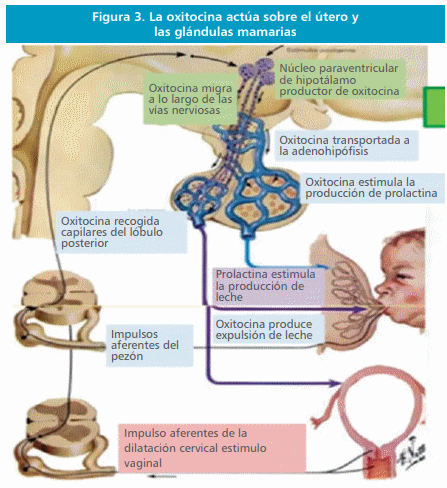
Funciones fisiológicas de la oxitocina

La oxitocina produce la contracción del útero gestante
Como indica su nombre, la hormona oxitocina estimula con fuerza la contracción del útero en el
embarazo, en especial al final de la gestación. Por consiguiente, muchos tocólogos piensan que esta
hormona es la responsable, al menos en parte, de la inducción del parto. Esta opinión está respaldada
por los siguientes hechos: 1) cuando se secciona la hipófisis de la hembra preñada, la duración del
período de dilatación aumenta mucho, lo que indica un posible efecto de la oxitocina durante el parto;
2) la concentración plasmática de oxitocina asciende durante el parto, en especial en la última fase, y
3) la estimulación del cuello uterino de la hembra preñada desencadena señales nerviosas que pasan
al hipotálamo e incrementan la secreción de oxitocina

La oxitocina estimula la expulsión de leche por las mamas
La oxitocina también desempeña una función esencial en la lactancia; se conocen más detalles acerca
de esta función que de la relacionada con el nacimiento. Durante la lactancia, induce la expresión de leche desde los alvéolos hasta los conductos mamarios, de forma que el hijo pueda extraerla
mamando.