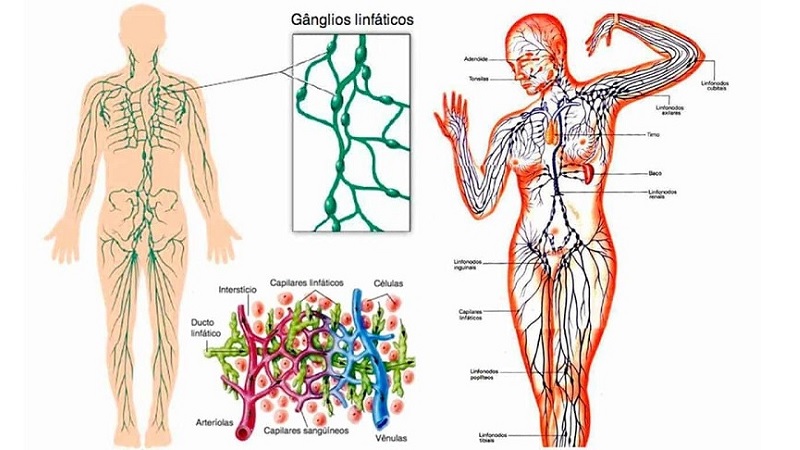
La microcirculación y el sistema linfático:
intercambio de líquido capilar, líquido
intersticial y flujo linfático
El principal objetivo de la microcirculación es el transporte de nutrientes hacia los tejidos y la eliminación de los restos celulares.
Las arteriolas pequeñas controlan el flujo sanguíneo hacia cada tejido y, a su vez, las condiciones locales de los tejidos controlan los diámetros de las arteriolas.
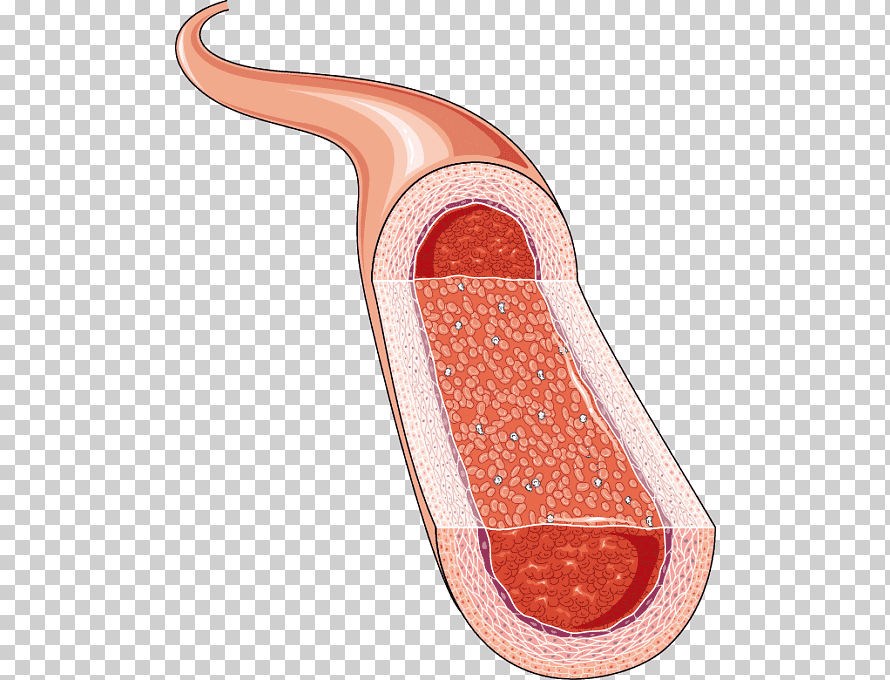
Las paredes de los capilares son finas, construidas con una sola capa de células endoteliales muy permeables, por lo que el agua, los nutrientes de la célula y los restos celulares pueden intercambiarse con rapidez y fácilmente entre los tejidos y la sangre circulante.

La circulación periférica de todo el organismo tiene alrededor de 10.000 millones de capilares con una superficie total estimada de 500-700 m.
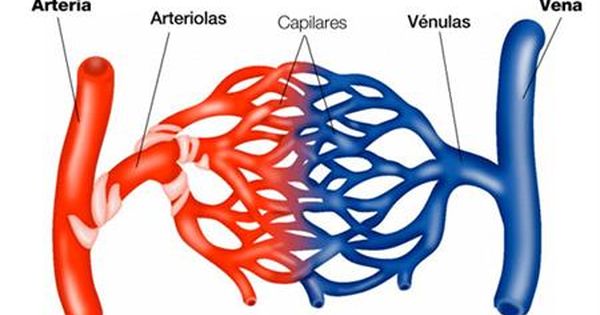
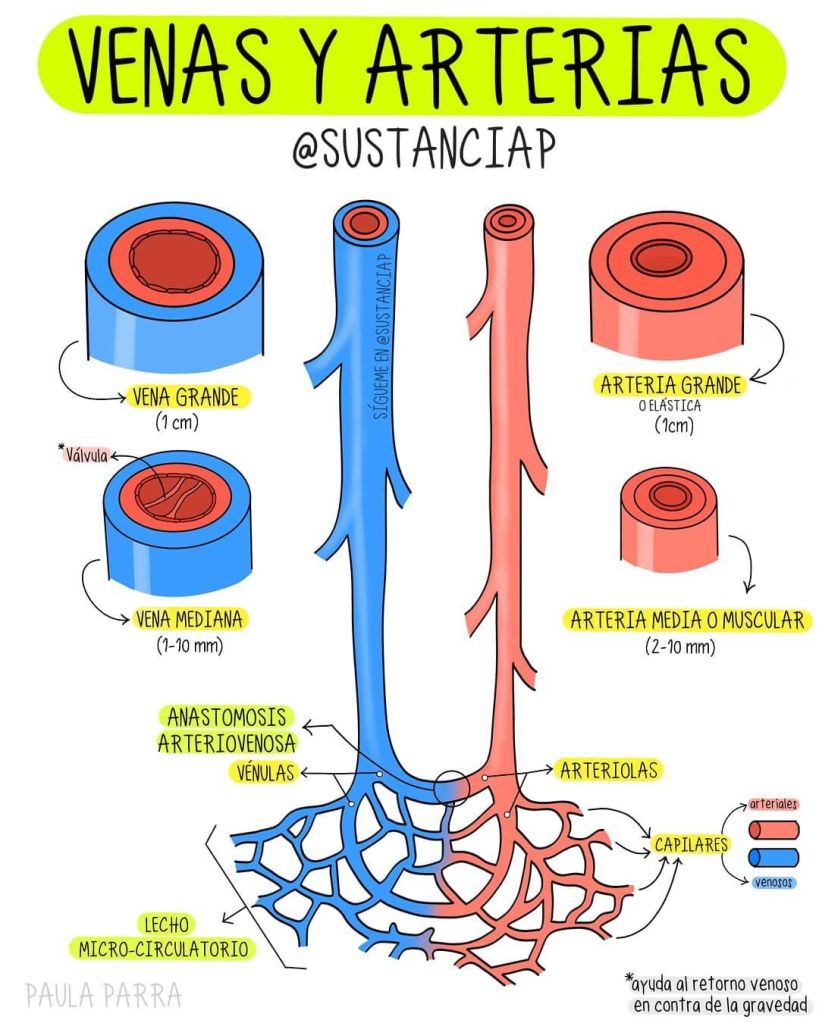
Estructura de la microcirculación y del sistema
capilar
Las vénulas son mayores que las arteriolas y tienen una capa muscular mucho más débil.
A pesar de ello, la presión de las vénulas es mucho menor que la de las arteriolas, por lo que las vénulas aún pueden contraerse considerablemente, a pesar de su capa muscular débil.
Esta distribución típica del lecho capilar no se encuentra en todas las partes del cuerpo, aunque algunas distribuciones similares pueden servir para el mismo objetivo.
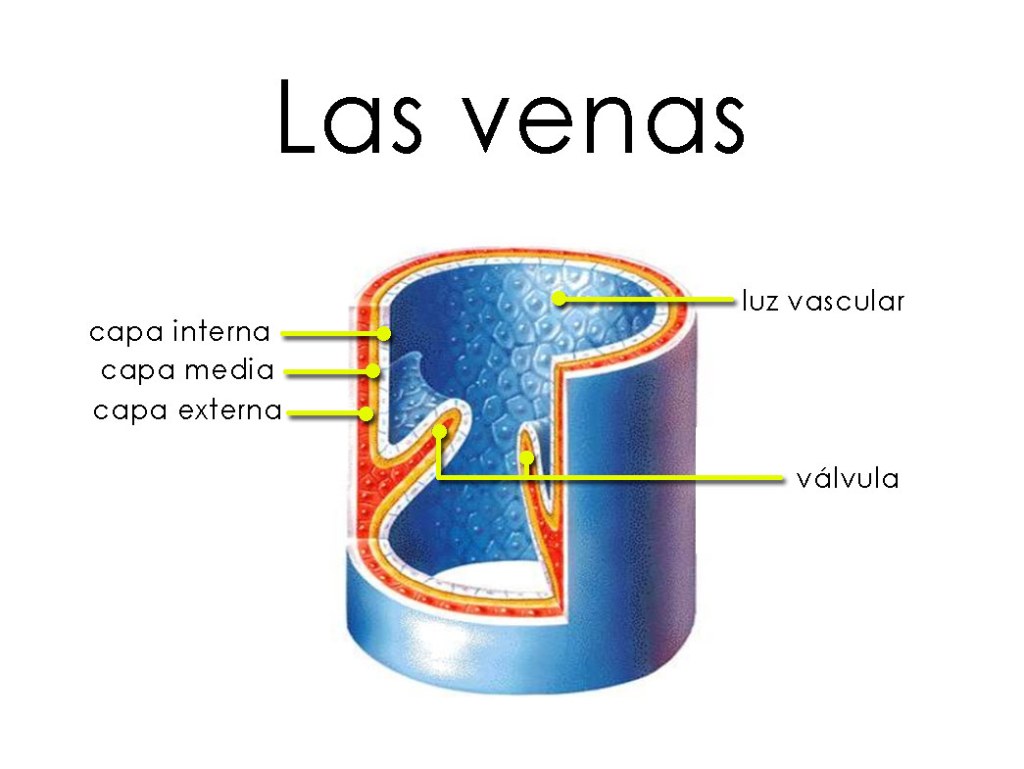
Estructura de la pared capilar
la pared está compuesta por una capa unicelular de células endoteliales y rodeada por una membrana basal muy fina en el exterior del capilar.
El grosor total de la pared capilar es de solo unas 0,5 μm, el diámetro interno del capilar es de 4-9 μm, apenas suficiente para el paso de los eritrocitos y otras células sanguíneas exprimidas.
Poros en la membrana capilar

Cada espacio está interrumpido periódicamente por pliegues cortos de inserciones de proteínas que mantienen unidas las células endoteliales, pero entre esos pliegues puede filtrarse libremente el líquido a través del espacio.
El espacio suele tener un tamaño uniforme, con una anchura de 6-7 nm (60-70 angström),
En las células endoteliales también hay muchas vesículas de plasmalema, denominadas asimismo cavéolas (pequeñas cuevas).
Las vesículas de plasmalema se forman a partir de oligómeros de proteínas llamadas caveolinas que están asociadas con moléculas de colesterol y esfingolípidos.
Aunque siguen sin estar claras las funciones exactas de las cavéolas, se cree que tienen una función en la endocitosis (el proceso por el cual la célula atrapa material del exterior de la misma) y en la transcitosis de macromoléculas en el interior de las células endoteliales.
Las cavéolas en la superficie de la célula parecen embeber pequeños paquetes de plasma o líquido extracelular que contiene proteínas plasmáticas; Estas vesículas se pueden desplazar lentamente a través de la célula endotelial.
Tipos especiales de poros en los capilares de algunos órganos:
En el cerebro, las uniones entre las células endoteliales capilares son principalmente uniones estrechas que permiten la entrada y salida de moléculas muy pequeñas como agua, oxígeno y dióxido de carbono en los tejidos cerebrales.
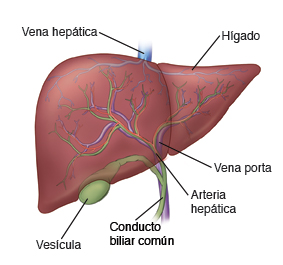
En el higado, los espacios entre las células endoteliales capilares son aperturas amplias, por lo que casi todas las sustancias disueltas en el plasma, incluidas las proteínas plasmáticas, pueden pasar de la sangre a los tejidos hepáticos
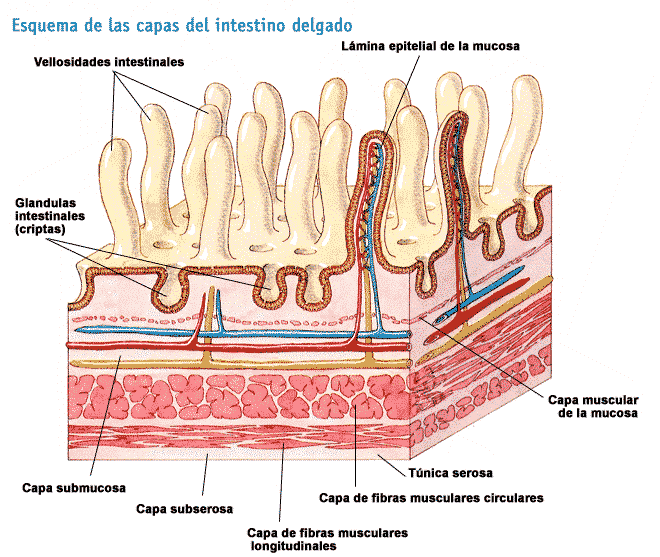
Los poros de las membranas capilares gastrointestinales tienen un tamaño intermedio entre las de los músculos y las del hígado.
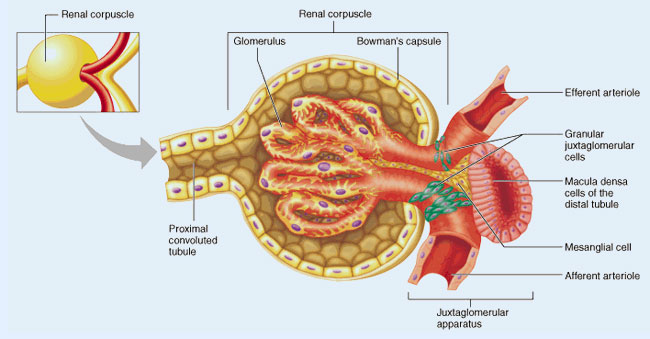
En los capilares glomerulares del riñón se abren numerosas membranas ovales, denominadas
fenestraciones, que atraviesan en todo su trayecto las células endoteliales, por lo que pueden filtrarse cantidades enormes de moléculas pequeñas e iones
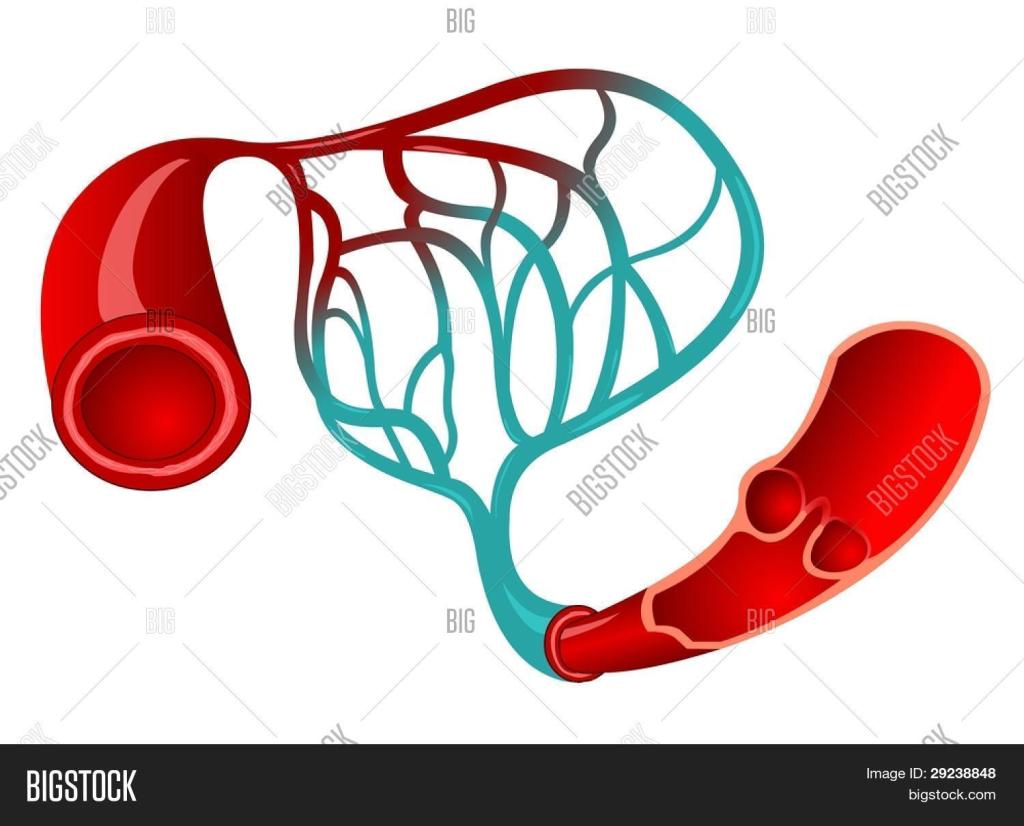
Flujo de sangre en los capilares: vasomotilidad
La sangre no fluye continuamente a través de los capilares, sino que lo hace de forma intermitente apareciendo y desapareciendo cada pocos segundos o minutos.
Vasomotilidad significa la contracción intermitente de las metaarteriolas y esfínteres precapilares (y, a veces, también de las arteriolas muy pequeñas).
Regulación de la vasomotilidad:
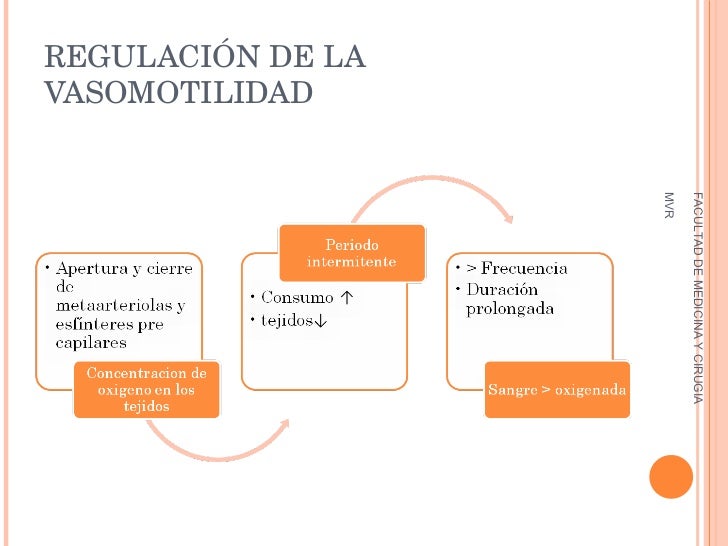
El factor más importante que afecta al grado de apertura y cierre de las metaarteriolas y de los esfínteres precapilares, y que se ha descubierto hasta la fecha, es la concentración de oxígeno en los tejidos.
Cuando la velocidad de utilización del oxígeno por el tejido es mayor, de forma que la concentración de oxígeno tisular disminuye por debajo de lo normal, se activan los períodos intermitentes del flujo sanguíneo capilar más a menudo y la duración de cada período del flujo es más prolongada, con lo que se permite que la sangre capilar transporte mayores cantidades de oxígeno (y de otros nutrientes) hacia los tejidos.
A pesar de que el flujo sanguíneo a través de cada capilar es intermitente, hay tantos capilares en los tejidos que su función global termina por ser superada, es decir, hay una velocidad media del flujo sanguíneo a través de cada lecho capilar tisular, una presión capilar media dentro de los capilares y una velocidad de transferencia media de las sustancias entre la sangre de los capilares y el líquido
intersticial circundante.
Intercambio de agua, nutrientes y otras sustancias
entre la sangre y el líquido intersticial
La difusión es consecuencia del movimiento térmico de las moléculas
de agua y de otras sustancias disueltas en el líquido, con las distintas moléculas e iones desplazándose primero en una dirección y luego en otra, rebotando aleatoriamente en cada una de ellas.
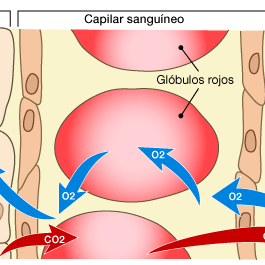
Las sustancias liposolubles difunden directamente a través de las membranas celulares del endotelio capilar
Las sustancias liposolubles, como el oxigeno y el dióxido de carbono se difunden directamente a través de las membranas celulares del capilar sin tener que atravesar los poros, sus velocidades de transporte a través de la membrana capilar son muchas veces más rápidas.
Las sustancias hidrosolubles y no liposolubles difunden solo a través de los poros intercelulares en la membrana capilar
Muchas sustancias que necesitan los tejidos son solubles en agua pero no pueden pasar a través de las membranas lipídicas de las células endoteliales; estas sustancias son las propias moléculas de agua, los iones sodio y cloruro y la glucosa.

La profundidad de los espacios intercelulares capilares, 6 a 7 nm, es unas 20 veces el diámetro de la molécula de agua, que es la molécula más pequeña que normalmente atraviesa los poros de los capilares.
La permeabilidad de los poros del capilar para distintas sustancias varía según sus diámetros moleculares.
La velocidad «neta» de difusión de una sustancia a través de cualquier membrana es proporcional a la diferencia de concentración de la sustancia entre los dos lados de la membrana. Es decir, cuanto mayor sea la diferencia entre las concentraciones de una sustancia dada en los dos lados de la membrana capilar, mayor será el movimiento neto de la sustancia en una dirección a través de la
membrana.
Intersticio y líquido intersticial
Una sexta parte del volumen total del organismo consiste en espacios entre las células, que colectivamente se conoce como el intersticio.
Contiene dos tipos principales de estructuras sólidas:

Recorren largas distancias en el intersticio. Son muy fuertes, por lo que proporcionan la mayor parte de la fuerza tensional de los tejidos
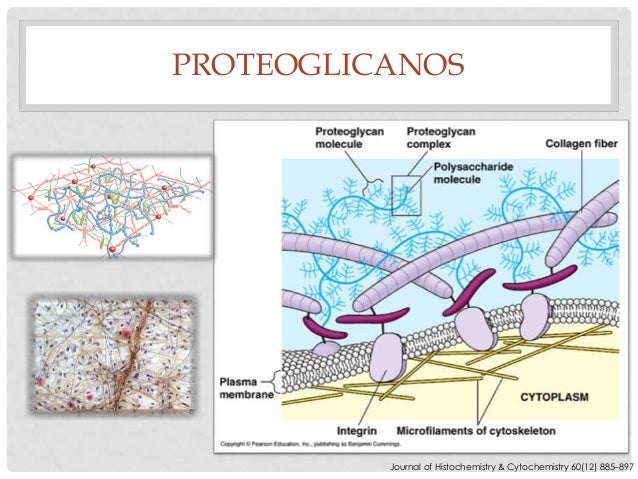
Son moléculas muy finas enrolladas o retorcidas compuestas por un 98% de ácido hialurónico y un 2% de proteínas.
El líquido del intersticio deriva por filtración y difusión de los capilares. Contiene casi los mismos componentes que el plasma, excepto por concentraciones mucho más bajas de proteínas, porque las proteínas no atraviesan los poros de los capilares.
El líquido intersticial queda atrapado principalmente en los diminutos espacios que hay entre los filamentos de proteoglucanos.
Esta combinación de filamentos de proteoglucano y líquido atrapado dentro de ellos tiene las características de un gel y, por tanto, se conoce como gel tisular.
Aunque casi todo el líquido del intersticio está atrapado dentro del gel tisular, a veces también hay pequeños riachuelos de líquido «libre» y pequeñas vesículas de líquido libre, lo que significa que carece de moléculas de proteoglucano y, por tanto, puede fluir libremente.
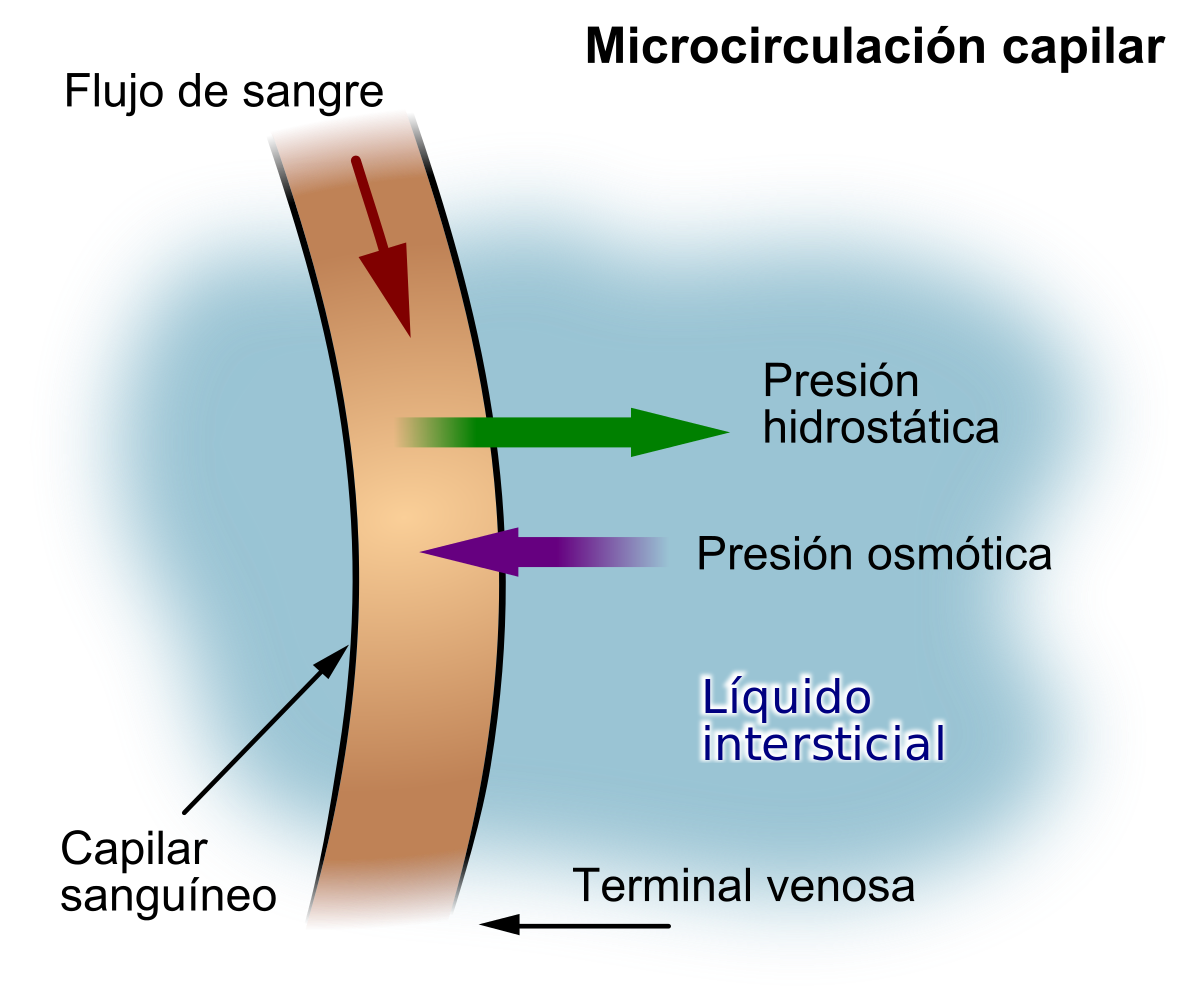
La filtración de líquidos a través de los capilares se encuentra determinada por las presiones hidrostática y coloidosmótica y por el coeficiente de filtración capilar
La presión hidrostática en los capilares tiende a empujar el líquido y a las sustancias disueltas a través de los poros capilares dentro de los espacios intersticiales. Por el contrario, la presión osmótica provocada por las proteínas plasmáticas (lo que se conoce como presión coloidosmótica) tiende a provocar el movimiento del líquido por ósmosis desde los espacios intersticiales hacia la sangre.
La presión hidrostática en los capilares tiende a empujar el líquido y a las sustancias disueltas a través de los poros capilares dentro de los espacios intersticiales. Por el contrario, la presión osmótica provocada por las proteínas plasmáticas (lo que se conoce como presión coloidosmótica) tiende a provocar el movimiento del líquido por ósmosis desde los espacios intersticiales hacia la sangre.
El sistema linfático también tiene su importancia, al devolver a la circulación las pequeñas cantidades del exceso de proteína y líquido que se pierde desde la sangre hacia los espacios intersticiales.
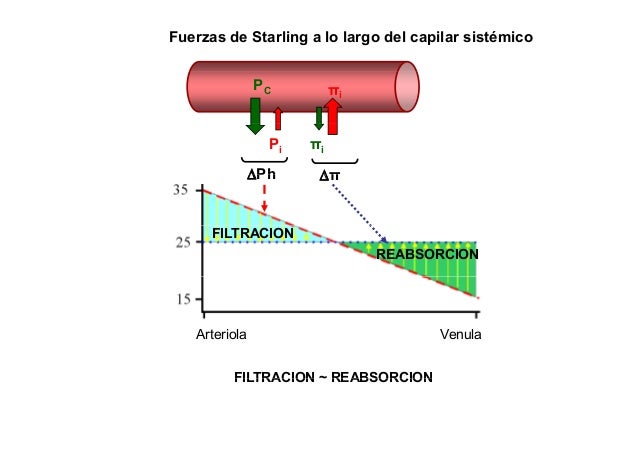
Las fuerzas hidrostáticas y la coloidosmótica determinan el movimiento del líquido a través de la membrana capilar.

Fuerzas de Starling en honor al fisiólogo Ernest Starling, que demostró su importancia por primera vez, son:
- La presión capilar (Pc), que tiende a forzar la salida del líquido a través de la membrana capilar.
- La presión del líquido intersticial (Pif), que tiende a forzar la entrada del líquido a través de la membrana capilar cuando la Pif es positiva, pero fuerza la salida cuando la Pif es negativa.
- La presión coloidosmótica del plasma en el capilar (Πp), que tiende a provocar ósmosis de líquido hacia el interior a través de la membrana capilar.
- La presión coloidosmótica del líquido intersticial (Πif), que tiende a provocar la ósmosis del líquido hacia el exterior a través de la membrana capilar.
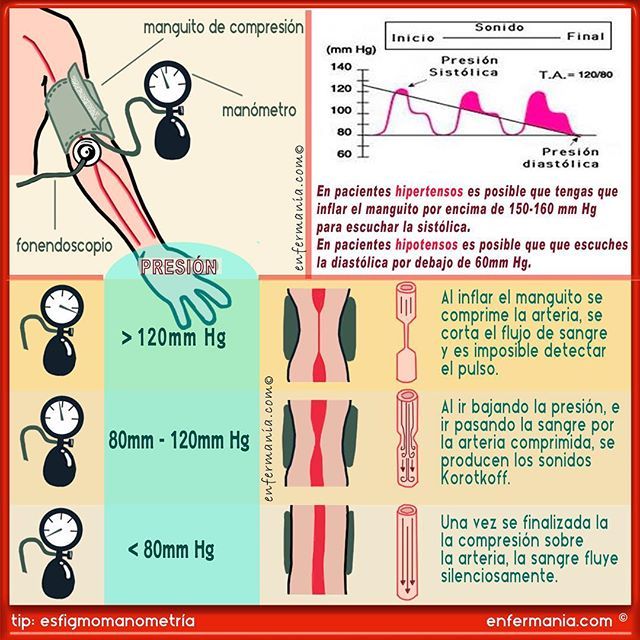
Presión hidrostática capilar:
Para estimar la presión hidrostática capilar:
- Canulación directa de los capilares con la micropipeta, que da una presión capilar media de 25 mmHg en algunos tejidos como el músculo esquelético y el aparato digestivo
- Determinación funcional indirecta de la presión capilar, que da una presión capilar media en torno a 17 mmHg en estos tejidos.
Presión hidrostática del líquido intersticial
En tejido subcutáneo poco compacto, la presión del líquido intersticial determinada por los diferentes métodos es normalmente unos milímetros de mercurio menor que la presión atmosférica; en consecuencia, los valores se designan como presión negativa del líquido intersticial.
En otros tejidos que están rodeados por cápsulas, como los riñones, la presión intersticial suele ser positiva (es decir, mayor que la atmosférica).
Los métodos más usados han sido:
- Medida directa de la presión con una micropipeta introducida en los tejidos
- Determinación de la presión desde cápsulas perforadas implantadas
- Determinación de la presión desde una mecha de algodón insertada en el tejido.
Algunos tejidos del organismo están rodeados por una carcasa rígida, como la bóveda craneal alrededor del cerebro, la cápsula fibrosa fuerte que rodea el riñón, las vainas fibrosas de los músculos y la esclerótica que rodea el ojo.
En la mayoría de estos tejidos, e independientemente del método usado para la determinación, la presión del líquido intersticial suele ser positiva:
Las presiones que se han podido medir en la mayoría de las cavidades naturales del organismo en las que hay líquido libre en equilibrio dinámico con los líquidos intersticiales circundantes son negativas.
Algunas de estas cavidades y las determinaciones de las presiones son las siguientes:
• Espacio intrapleural: –8 mmHg.
• Espacio sinovial articular: –4 a –6 mmHg.
• Espacio epidural: –4 a –6 mmHg.
Aunque los distintos métodos mencionados anteriormente obtienen valores discretamente diferentes de la presión del líquido intersticial, la mayoría de los fisiólogos creen que la presión del líquido intersticial en el tejido subcutáneo laxo es, en condiciones normales, algo menor que la atmosférica, con un promedio de –3 mmHg.
Presión coloidosmótica del plasma
Para distinguir esta presión osmótica que se produce en la membrana celular se denomina presión coloidosmótica o presión oncótica.
El término presión osmótica «coloide» se debe a que la solución de proteínas se parece a una solución coloidal, a pesar de que realmente es una solución molecular verdadera.
La presión coloidosmótica del plasma humano normal alcanza un promedio de 28 mmHg, de los que 19 mm se deben a los efectos moleculares de las proteínas disueltas y 9 mm al efecto de Donnan, es decir, a la presión osmótica extra causada por el sodio, el potasio y los demás cationes que las proteínas mantienen en el plasma.
Intercambio de volumen de líquido a través de la membrana capilar:
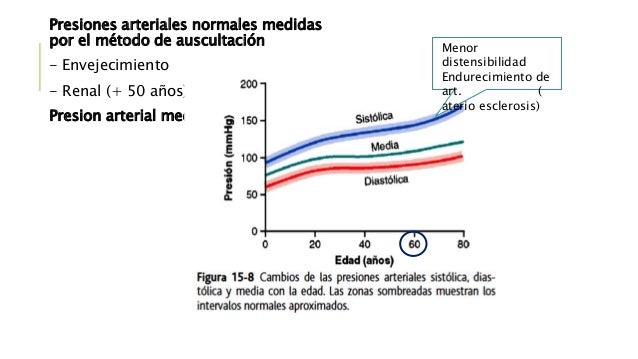
La presión capilar media en los extremos arteriales de los capilares es 15 a 25 mmHg mayor que en los extremos venosos.
Debido a esta diferencia, el líquido «se filtra» fuera de los capilares en los
extremos arteriales, pero en los extremos venosos vuelve a ser reabsorbido en los capilares.
Es decir, una pequeña cantidad de líquido fluye realmente a través de los tejidos desde los extremos arteriales de los capilares a los extremos venosos.
Equilibrio de Starling para el intercambio capilar:
Ernest Starling señaló hace más de un siglo que, en condiciones normales, existe un estado cercano al equilibrio en la mayoría de los capilares, es decir, que la cantidad de líquido que se filtra de los extremos arteriales de los capilares hacia el exterior es casi exactamente igual a la de líquido que vuelve a la circulación mediante absorción.
Coeficiente de filtración capilar:
La velocidad de filtración neta de líquidos según el desequilibrio por cada milímetro de mercurio se encuentra una velocidad de filtración neta de 6,67 ml/min de líquido por minuto por mmHg para todo el organismo.
Este valor recibe el nombre de coeficiente de filtración capilar corporal total.
El coeficiente de filtración también puede expresarse en las distintas partes del organismo en términos de velocidad de filtración por minuto por mmHg por 100 g de tejido.
Según esto, el coeficiente de filtración capilar de un tejido medio es de unos 0,01 ml/min/mmHg/100 g de tejido.
Efecto de las alteraciones del equilibrio de fuerzas en la membrana capilar:
Si la presión capilar media aumenta por encima de 17 mmHg aumenta también la fuerza neta que tiende a causar la filtración de líquido en los espacios tisulares.
Es decir, un aumento de 20 mmHg de la presión capilar media provoca un incremento de la presión de filtración de 0,3 mmHg a 20,3 mmHg, con lo que se consigue una filtración neta hasta 68 veces mayor que la que ocurre normalmente en los espacios intersticiales.
Para prevenir la acumulación del exceso de líquido en estos espacios se requiere 68 veces más flujo de líquido normal en el sistema linfático, una cantidad que es 2 a 5 veces mayor que la que pueden eliminar los vasos linfáticos.
Sistema linfático
El sistema linfático representa una vía accesoria a través de la cual el líquido puede fluir desde los espacios intersticiales hacia la sangre; siendo los vasos linfáticos los que transportan las proteínas y las macropartículas de los espacios tisulares, ya que ninguna de estas podrá ser eliminada por absorción directamente hacia los capilares sanguíneos.
Vasos linfáticos del organismo:
Casi todos los tejidos del organismo tienen vasos linfáticos especiales que drenan el exceso de líquido directamente desde los espacios intersticiales.
Los tejidos tienen canales intersticiales diminutos que se denominan canales
prelinfáticos, a través de los cuales puede fluir el líquido intersticial; este líquido se vacía finalmente en los vasos linfáticos o, en caso del cerebro, en el líquido cefalorraquídeo, y después directamente de vuelta a la sangre.
Todos los vasos linfáticos de la mitad inferior del organismo se vaciarán en el conducto torácico, que a su vez se vacía en el sistema venoso en la unión de la vena yugular interna con la vena subclavia izquierda.


La linfa de la mitad izquierda de la cabeza, el brazo izquierdo y algunos territorios del tórax entra en el conducto torácico antes de que se vacíe en las venas.

La linfa del lado derecho del cuello y la cabeza, el brazo derecho y algunos territorios del tórax derecho entra en el conducto torácico derecho (mucho menor que el conducto torácico izquierdo), que se vacía en el sistema venoso en la unión de la vena subclavia derecha y la vena yugular interna.
Capilares linfáticos terminales y su permeabilidad:
La mayoría del líquido que se filtra desde los extremos arteriales de los capilares sanguíneos fluye entre las células y, por último, se reabsorbe de nuevo hacia los extremos venosos de los capilares sanguíneos; pero, como media, aproximadamente la décima parte del líquido entra en los capilares linfáticos y vuelve hacia la sangre a través del sistema linfático y no al contrario, a través de los capilares venosos.
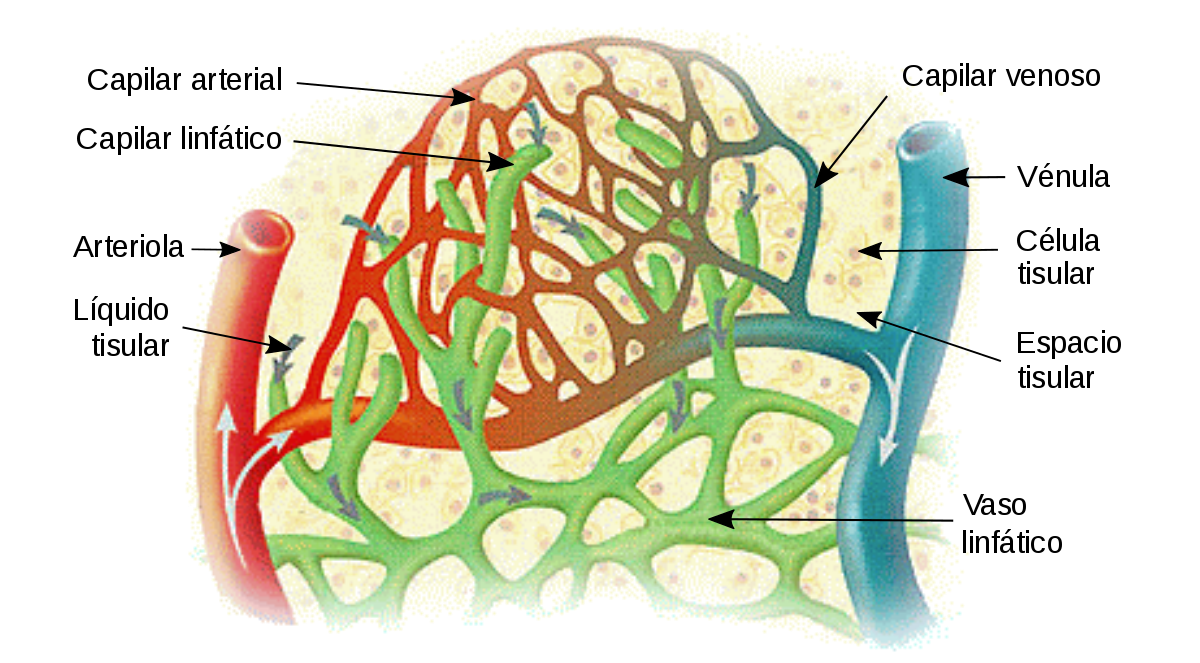
El líquido que vuelve a la circulación a través de los linfáticos es muy importante porque las sustancias de alto peso molecular que contiene, como las proteínas, no pueden ser absorbidas desde los tejidos de ninguna otra forma, aunque pueden entrar en los capilares linfáticos casi sin impedimentos.
En las uniones de las células endoteliales adyacentes vemos cómo el borde de una célula endotelial se superpone al borde de la célula adyacente de tal forma que el borde que se superpone carece de la entrada abatible formando una válvula diminuta que se abre hacia el interior del capilar linfático.
El líquido intersticial, junto a las partículas en suspensión que contiene, empuja la válvula abierta y fluye directamente hacia los capilares linfáticos, pero tiene problemas para abandonar los capilares una vez que ha entrado porque el más mínimo flujo retrógrado cierra la válvula abatible.
Formación de la linfa.
La linfa deriva del líquido intersticial que fluye en los linfáticos, por lo que la linfa que entra primero en los vasos linfáticos terminales tiene casi la misma composición que el líquido intersticial.
La concentración de proteínas en el líquido intersticial de la mayoría de los tejidos alcanza un promedio de 2 g/dl y la concentración de proteínas del flujo linfático que procede de estos tejidos es aproximada a este valor.
Las partículas de gran tamaño, como las bacterias, consiguen avanzar entre las células endoteliales de los capilares linfáticos y entran en la linfa. Estas partículas se eliminan y destruyen casi en su totalidad cuando la linfa atraviesa los ganglios linfáticos.
Velocidad del flujo linfático:
En un ser humano en reposo pasan 100 ml por hora en el flujo linfático a través del conducto torácico, y otros 20 ml fluyen hacia la circulación cada hora a través de otros canales, con un total del flujo linfático estimado en torno a 120 ml/h o 2-3 l al día.
El flujo linfático normal es muy escaso con una presión del líquido intersticial más negativa que el valor normal de –6 mmHg.
Cuando la presión aumenta hasta 0 mmHg (presión atmosférica), el flujo aumenta más de 20 veces, por lo que cualquier factor que aumente la presión del líquido intersticial también aumenta el flujo linfático si los vasos linfáticos están funcionando normalmente.
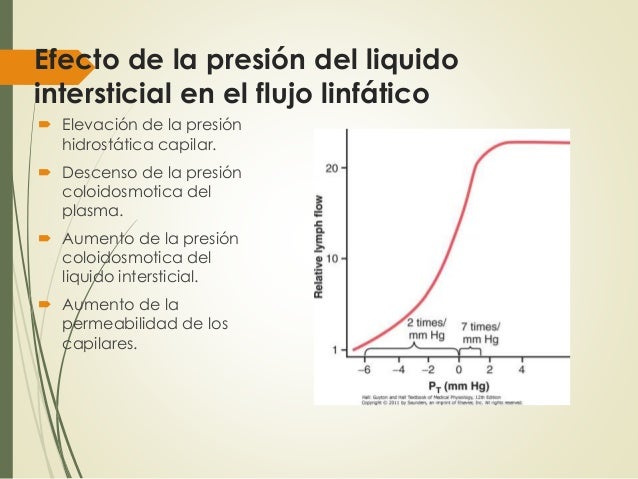
Todos estos factores consiguen el equilibrio del intercambio de líquidos en la membrana capilar sanguínea a favor del movimiento de líquido en el intersticio, con lo que aumentan al mismo tiempo el volumen del líquido intersticial, la presión del líquido intersticial y el flujo linfático.
La bomba linfática aumenta el flujo linfático:
Las válvulas normales de los linfáticos de recogida, en los que se vacían los capilares linfáticos.

Bomba linfática capilar:
El capilar linfático terminal también puede bombear la linfa, efecto que se suma al bombeo producido en los vasos linfáticos mayores.
Las paredes de los linfáticos están íntimamente adheridas a las células tisulares circundantes, mediante sus filamentos de anclaje.
Por tanto, cada vez que entra un exceso de líquido en el tejido y provoca la
hinchazón tisular, los filamentos de anclaje tiran de la pared de los capilares linfáticos y el flujo entrará en el capilar linfático terminal a través de los espacios situados entre las células endoteliales.

Las células endoteliales de los capilares linfáticos también contienen algunos filamentos contráctiles de actomiosina; al menos parte del efecto de
bomba de la linfa es consecuencia de la contracción de la célula endotelial linfática además de la contracción de los linfáticos musculares de mayor tamaño.
Los factores principales que determinan el flujo
linfático son:
- La presión del líquido intersticial
- La actividad de la bomba linfática.
El sistema linfático tiene un papel clave en el control de la concentración de proteínas, el volumen y la presión del líquido intersticial:
El sistema linfático funciona como un «mecanismo de rebosamiento» que devuelve a la circulación el exceso de proteínas y de volumen de líquido de los espacios tisulares.
Por tanto, el sistema linfático también tiene un papel importante para el control de:
La concentración de proteínas en los líquidos intersticiales
El volumen del líquido intersticial

Una vez que la concentración de proteínas en el líquido intersticial alcanza un
determinado nivel y provoca un aumento comparable del volumen y de la presión del líquido, el retorno de las proteínas y del líquido a través del sistema linfático es suficientemente grande como para equilibrar la velocidad de pérdida de ambos hacia el intersticio desde los capilares sanguíneos.
Por tanto, los valores cuantitativos de todos estos factores alcanzan un estado de equilibrio que se mantendrá hasta que algo cambie la velocidad de pérdida de proteínas y líquido de los capilares sanguíneos.















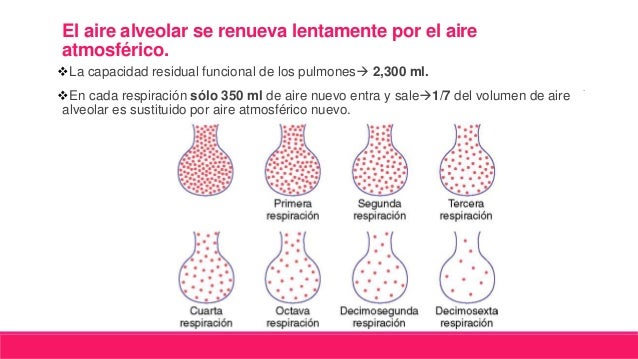
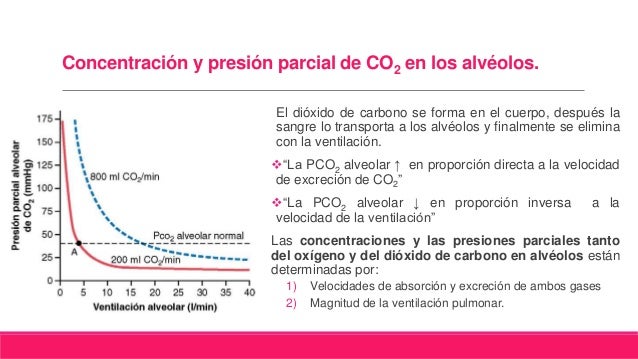

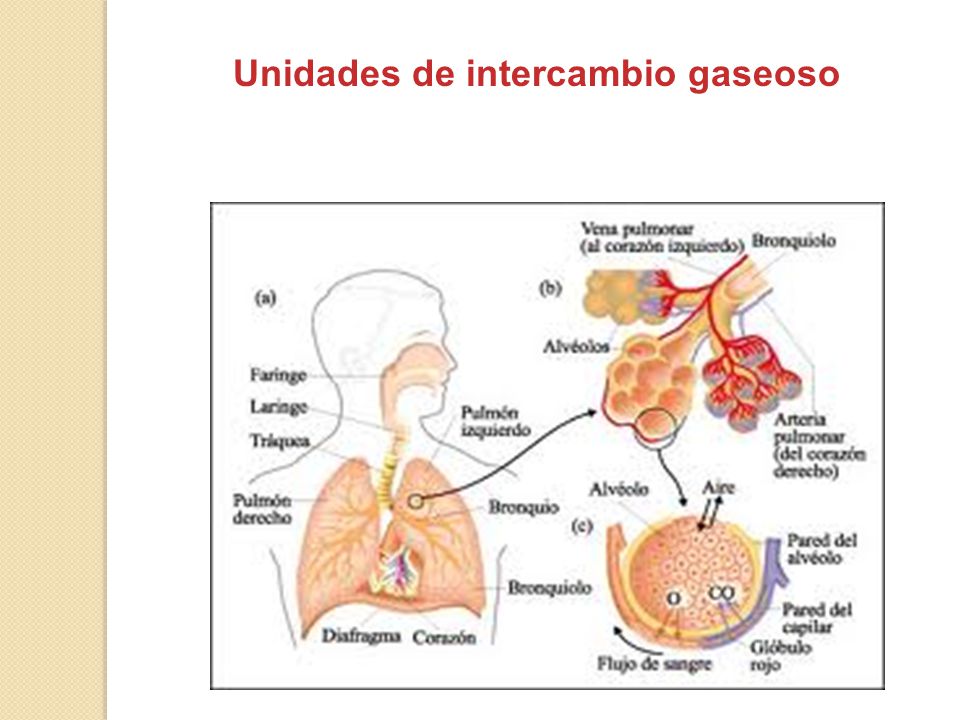
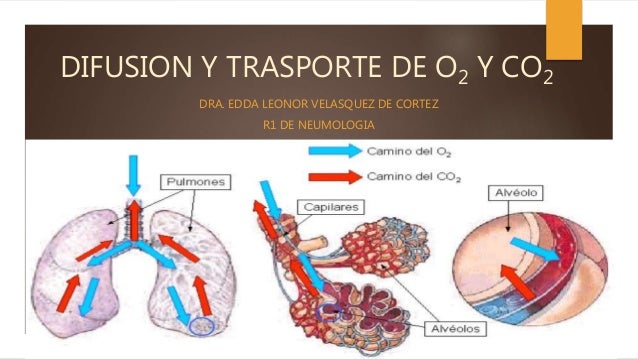




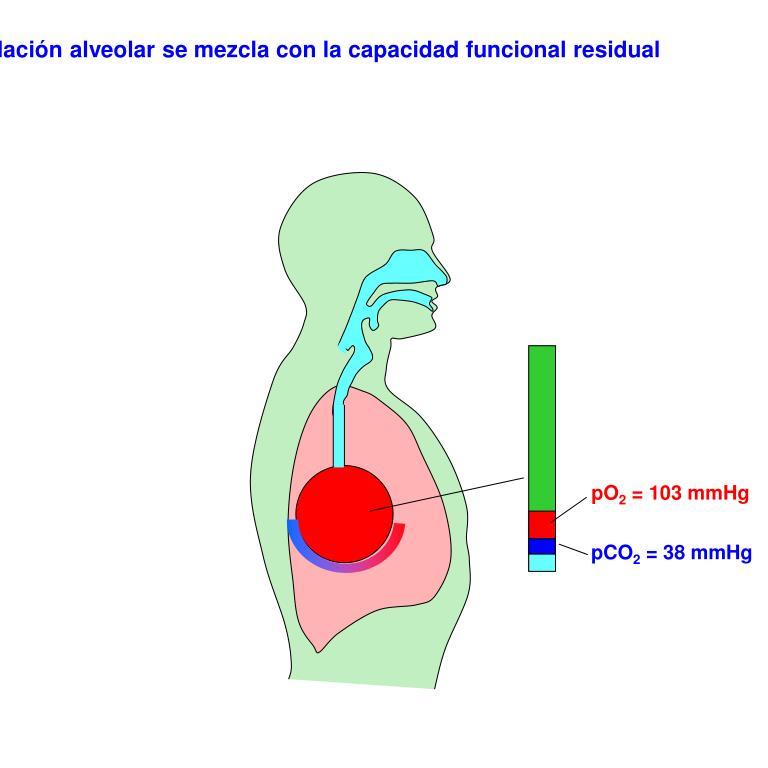

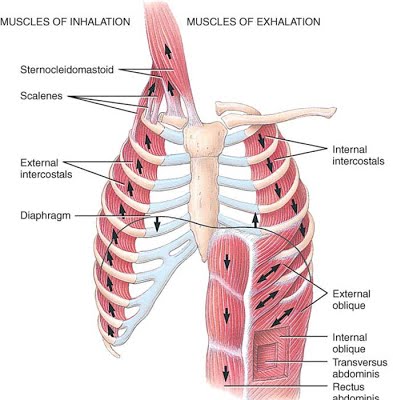

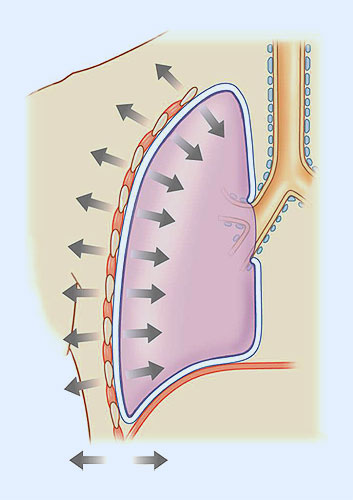 DISTENSIBILIDAD DE LOS PULMONES:
DISTENSIBILIDAD DE LOS PULMONES:

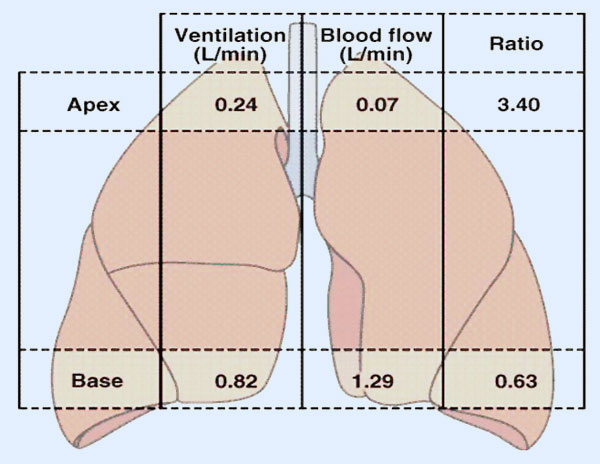 . VOLUMEN PULMONAR
. VOLUMEN PULMONAR CAPACIDAD PULMONAR
CAPACIDAD PULMONAR